
 从结构的角度可以帮助我们更好的理解有机物的化学性质.
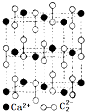
从结构的角度可以帮助我们更好的理解有机物的化学性质.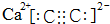 ,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3
,CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为1.92×10-22cm3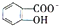 判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
判断相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是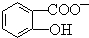 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+. 分析 (1)Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1,根据基态原子的电子排布式书写Cu+的电子排布式;根据价层电子对互斥理论判断丙烯腈分子中碳原子轨道杂化类型;[Cu(NH3)2]Cl的氨水溶液在空气中放置,+1价的铜迅速被氧气氧化,生成[Cu(NH3)4]2+为深蓝色;
(2)碳化钙属于离子化合物,阴阳离子需要标出所带电荷,阴离子需要标出最外层电子;晶胞的一个平面的长与宽不相等,所以1个Ca2+周围距离最近的C22-有4个,而不是6个,根据晶胞图算出每个晶胞中CaF2的数目,再根据V=$\frac{m}{ρ}$求算;
(3)甲醛(H2C=O)根据价层电子对互斥理论确定甲醛分子中的键角;氢键为分子间作用力,氢键影响物质的熔沸点;
(4)水杨酸第一级电离形成的离子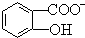 能形成分子内氢键,导致水杨酸根离子中酚羟基难电离出氢离子,据此分析解答.
能形成分子内氢键,导致水杨酸根离子中酚羟基难电离出氢离子,据此分析解答.
解答 解:(1)Cu为29号元素,Cu的基态原子的电子排布式为1s22s22p63s23p63d104s1,失去1个电子后生成Cu+,Cu+的基本电子排布式为1s22s22p63s23p63d10,H2C=CH-C≡N分子中连接双键的C原子价层电子对个数是3且不含孤电子对,所以为sp2杂化,连接三键的碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;[Cu(NH3)2]Cl的氨水溶液在空气中放置,+1价的铜迅速被氧气氧化,由无色变为深蓝色,反应为:4[Cu(NH3)2]++O2+8NH3?H2O=4[Cu(NH3)4]2++6H2O+4OH- 或4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-,
故答案为:1s22s22p63s23p63d10;sp、sp2;4[Cu(NH3)2]++O2+8NH3?H2O=4[Cu(NH3)4]2++6H2O+4OH- 或4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-;
(2)碳化钙属于离子化合物,阴离子中存在碳碳三键,碳化钙的电子式为: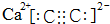 ,依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×$\frac{1}{4}$+1=4,一个晶胞中含有4个CaC2,CaC2晶体的密度为2.22g/cm3,该晶胞的体积为V=$\frac{m}{ρ}$=$\frac{4×64}{2.22×6.02×1{0}^{23}}$≈1.92×10-22cm3,
,依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,要特别注意题给的信息,CaC2晶体的晶胞结构与NaCl晶体的相似,该晶胞中含有Ca为12×$\frac{1}{4}$+1=4,一个晶胞中含有4个CaC2,CaC2晶体的密度为2.22g/cm3,该晶胞的体积为V=$\frac{m}{ρ}$=$\frac{4×64}{2.22×6.02×1{0}^{23}}$≈1.92×10-22cm3,
故答案为: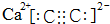 ;4;1.92×10-22;
;4;1.92×10-22;
(3)甲醛(H2C=O)甲醛中C原子价层电子对个数=3+0=3,所以C原子的杂化方式为sp2杂化,C-H与C-H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,所以甲醛分子中的键角大约为120度,氢键为分子间作用力,氢键影响物质的熔沸点,甲醇、甲醛均由分子构成,甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高,
故答案为:120度;甲醇有分子间氢键,甲醛没有分子间氢键;
(4)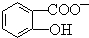 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚),
故答案为:<;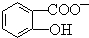 中-OH的氢原子形成分子内氢键,使其更难电离出H+.
中-OH的氢原子形成分子内氢键,使其更难电离出H+.
点评 本题考查了物质结构有关知识,涉及核外电子排布、轨道杂化、电子式、晶胞的计算、氢键等,为高频考点,注意平时获取题目信息利用信息解答问题能力的培养,题目综合性较强,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,22.4L氯化氢中含有氯原子的数目为NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有碳原子的数目为NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (5a+2b) kJ | B. | (4b-10a) kJ | C. | (5a-2b) kJ | D. | (10a+4b) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的分子式 Cl | B. | 钠原子的结构示意图 | ||
| C. | N2的电子式:N:::N: | D. | HClO的结构式 H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com