
����Ŀ��ͨ����ѧ����ѧϰ��ͬѧ�Ƕ��������Ļ����������˽�һ���˽⡣
��1������H��C��N��O��K����Ԫ�أ���ѡ�����е�Ԫ��д���������ʵĻ�ѧʽ��
����Ȼ������Ҫ�ɷ�____��
�ڼ�����Ѫ�쵰��ϵ��ж�����____��
���ܹ�������������____��
�ܿ������Ϸʵ������____��
��2����ͼ��ij��ʯ��Ʒ�и���Ԫ�غ����ı���ͼ��

�ٸ���ʯ�к�____�ַǽ���Ԫ�أ����к�����������____Ԫ�ء�
�������ӵĽṹʾ��ͼΪ ����X��____��
����X��____��
�۴���ʯ��Ʒ�в����ܺ��еĻ�������____��
A��CaCO3 B��K2SO4 C��Al2O3 D��SiO2
���𰸡�CH4 CO O2 KNO3 3 �� 11 A
��������
��1����Ȼ������Ҫ�ɷ��Ǽ��飬�仯ѧʽΪCH4��һ����̼������Ѫ�쵰��ϣ��仯ѧʽΪ![]() ���������Թ����������仯ѧʽΪO2������صĻ�ѧʽΪKNO3��
���������Թ����������仯ѧʽΪO2������صĻ�ѧʽΪKNO3��
��2������ͼ��֪������ʯ�к�����Ԫ�ء���Ԫ�ء���Ԫ�ع����ַǽ���Ԫ�أ�������Ԫ�صĺ�����ߣ�
�������ӵĺ���������������ԭ�ӵĺ�������������ԭ�ӵĺ���������Ϊ11�����x��11��
����ͼ��֪������ʯ�в���̼Ԫ�أ���˲����ܺ���CaCO3����A����ȷ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����

A. 25��ʱ����Mg(OH)2������Һ�м���������NH4Cl���壬c(Mg2��)����С
B. һ���¶��£���Ӧ��2HI(g)![]() H2(g)+I2(g) ��H��0�����Է����У���÷�Ӧ��S��0
H2(g)+I2(g) ��H��0�����Է����У���÷�Ӧ��S��0
C. ����з�̪��Na2CO3��Һ�еμ�BaCl2��Һ����ɫ����ȥ��˵��BaCl2��Һ������
D. ��ͼ��طŵ�ʱ��������Ӧʽ��2Li++Li2O2+2e��=2Li2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��ԭ������������������ֶ���������Ԫ�ء�W����̬�⻯��ˮ��Һ�ܿ�ʴ������XΪͬ������ԭ�Ӱ뾶����Ԫ�أ�Y�ĵ����ڳ�������Ũ����ۻ���Z��Wͬ���塣�ش��������⣺
(l)W��Ԫ�����ڱ��е�λ����____��
(2)Z�ĵ�����ˮ��Ӧ���ɺ�������ӵĵ���ʽΪ____��
(3)X������������Ӧˮ������Һ��Y�ĵ��ʷ�Ӧ���䷴Ӧ�����ӷ���ʽΪ____��
(4)����ͨ������Y��Z�γɵĻ�����ˮ��Һ���õ�������ԭ����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ܱ������м��� 0.3 mol A��0.1 mol C ��һ������ B �������壬 һ�������·������·�Ӧ��3A(g) ![]() B(g)��2C(g)�������ʵ�Ũ����ʱ��仯��ͼ��ʾ[t0��t1 �ε� c(B)�仯δ����]������˵������ȷ����
B(g)��2C(g)�������ʵ�Ũ����ʱ��仯��ͼ��ʾ[t0��t1 �ε� c(B)�仯δ����]������˵������ȷ����

A. ��t1��15s, A ��Ũ�ȱ仯��ʾ t0��t1�ε�ƽ����Ӧ����Ϊ 0.09 mol��L��1��s��1
B. t0��t1��,�˹����������ų�a kJ�������÷�Ӧ���Ȼ�ѧ����ʽΪ��3A(g)![]() B(g)��2C(g) ��H����50a kJ��mol��1
B(g)��2C(g) ��H����50a kJ��mol��1
C. ���������ݻ�Ϊ2 L��B����ʼ�����ʵ���Ϊ0.03 mol
D. t1ʱ�÷�Ӧ�ﵽƽ����A ��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ���������ֵ������˵������ȷ����( )
��0.5molO3��11.2LO2�����ķ�����һ�����
�ڱ�״���£�22.4L��������������ַ�Ӧ��ת�Ƶĵ�����Ϊ3NA
��ͨ��״���£�NA ��CO2����ռ�е����Ϊ22.4L
�ܳ��³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
�ݳ����£�4.4g CO2��N2O������Ӧ��������������е�ԭ����Ϊ0.3 NA
���ڷ�ӦKIO3��6HI===KI��3I2��3H2O�У�ÿ����3molI2ת�Ƶĵ�����Ϊ6NA
�߱�״����,22.4 L SO3���еķ�����ΪNA
���ڳ��³�ѹ�£�1 mol O2���е�ԭ����Ϊ2NA.
�����ʵ���Ũ��Ϊ0.5 mol��L-1 MgCl2��Һ��,����Cl������ΪNA
�⽫100 mL 0.1 mol��L-1��FeCl3��Һ�����ˮ�п��Ƶ�Fe(OH)3������ĿΪ0.01NA
A. �٢ڢܢ�B. �ܢݢ�C. �ۢޢ��D. �ܢݢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���ó�Ϊ����һ���µ��������������̼�IJ�����������Դ�����һ����Ҫ�о����������������й�ͼʾ����ѧ֪ʶ�ش�
I����CO2�����������ȡ��ϩ��CO2��g��+3H2��g��![]() 1/2C2H4��g��+2H2O��g����
1/2C2H4��g��+2H2O��g����
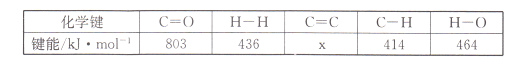
(l)���÷�Ӧ��ϵ�������淴Ӧ���̱仯��ϵ��ͼ��ʾ����÷�Ӧ��H =___________���ú�a��b��ʽ�ӱ�ʾ������֪����ػ�ѧ���ļ������±���ʾ��ʵ����������Ӧ�ġ�H =-152 kJ/mol������е�x= ___��
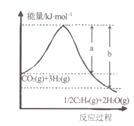
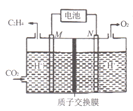
(2)��ϡ����Ϊ�������Һ������̫���ܵ�ؽ�CO2ת��Ϊ��ϩ�Ĺ���ԭ����ͼ��ʾ����M���ϵĵ缫��ӦʽΪ____��
II����CO2�����������ȡ�����ѣ�2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����H =-122.5kJ/mol��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��
CH3OCH3��g��+3H2O��g����H =-122.5kJ/mol��ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��
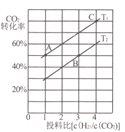
(3)ͼ��T1��T2�ֱ��ʾ��Ӧ�¶ȣ��ж�T1��T2��С��ϵ��������____��ͼ��A��B��C�����Ӧ��ƽ�ⳣ���ֱ�ΪKA��KB��Kc�������ߴ�С�Ĺ�ϵ��____��
(4)T1�¶��£���6molCO2��12molH2����2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬��0��5min�ڵ�ƽ����Ӧ���ʦ�(H2)=_______��ƽ�ⳣ��K=__���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ֶ�����Ԫ��a��g���й���Ϣ���±���ʾ��
Ԫ�ر�� | a | b | c | d | e | f | g |
ԭ�Ӱ뾶/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
����ϼۻ���ͻ��ϼ� | +1 | ��2 | +3 | ��2 | +3 | +1 | +1 |
�����ƶϲ���ȷ���ǣ�������
A. �⻯���ȶ��Ե�ǿ����b��dB. �����Ե�ǿ����f��g
C. Ԫ��e��������ֻ�����ᷴӦD. Ԫ��a��Ԫ��d�γɵĻ��������ڹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г���һ����SO2��O2������Ӧ2SO2��g��+O2��g��![]() 2SO3��g��, ���SO3Ũ���뷴Ӧ�¶ȹ�ϵ��ͼ������˵����ȷ����
2SO3��g��, ���SO3Ũ���뷴Ӧ�¶ȹ�ϵ��ͼ������˵����ȷ����

A. �÷�Ӧ��H��0 B. SO2ת���ʣ�a��b��c
C. ��ѧ��Ӧ���ʣ�c��b��a D. ƽ�ⳣ��K��b��c��a
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com