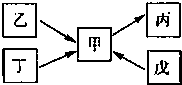
甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示.
(1)若R为一种非金属元素,且上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H
2的密度为14.写出由甲生成戊的化学方程式
,
欲检验乙中官能团,所选用的试剂为(填序号)
①④⑤
①④⑤
.
①NaOH溶液②Br
2的CCl
4溶液③银氨溶液④AgNO
3溶液⑤稀HNO
3(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16.丁为空气的主要成分之一.则丁的电子式为
,乙的空间构型为
三角锥形
三角锥形
,戊的稀溶液能跟过量铁粉反应,其离子方程式为
3Fe+8H++2NO-3=3Fe2++2NO↑+4H2O
3Fe+8H++2NO-3=3Fe2++2NO↑+4H2O
.
(3)若R为一种金属元素,甲溶液的pH小于7,乙由两种元素组成,单质丁在一定条件下可生成戊.甲与戊两种溶液混合能生成沉淀丙,其离子方程式为
Al3++3AlO-2+6H2O=4Al(OH)3↓
Al3++3AlO-2+6H2O=4Al(OH)3↓
,若镁粉中混有少量的丁,除去丁的离子方程式为
2Al+2H2O+2OH-=2AlO-2+3H2↑
2Al+2H2O+2OH-=2AlO-2+3H2↑
.

 甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示.
甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示.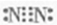
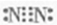
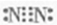 ,则乙为NH3,为三角锥形分子,戊的稀溶液能跟过量铁粉反应,应为HNO3,反应的化学方程式为3Fe+8H++2NO-3=3Fe2++2NO↑+4H2O,
,则乙为NH3,为三角锥形分子,戊的稀溶液能跟过量铁粉反应,应为HNO3,反应的化学方程式为3Fe+8H++2NO-3=3Fe2++2NO↑+4H2O,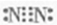 ;三角锥形; 3Fe+8H++2NO-3=3Fe2++2NO↑+4H2O;
;三角锥形; 3Fe+8H++2NO-3=3Fe2++2NO↑+4H2O;

 作业辅导系列答案
作业辅导系列答案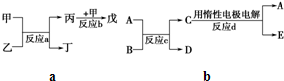

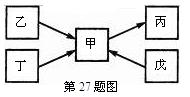
 6。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为 。
6。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为 。