
【题目】在25 ℃时,在容积为2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
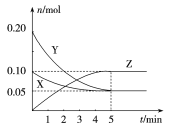
则下列叙述错误的是( )
A. 反应进行到5分钟时达到平衡
B. 25 ℃时,反应可表示为X(g)+3Y(g)![]() 2Z(g)
2Z(g)
C. 增大压强可使反应速率减小
D. 从反应开始到5 min,用Z表示的反应速率为0.01 mol·L-1·min-1
【答案】C
【解析】
A、根据平衡状态的特征进行回答;B、根据物质的量的变化判断反应物和生成物,根据物质的量的变化量之比等于化学计量数之比书写方程式,注意该反应为可逆反应,应该用可逆号;C、根据压强的变化对反应速率的影响关系来判断.D、根据v=△c/△t来计算;
A、由图示知,反应进行到5分钟时各物质的物质的量不再改变,达到平衡状态,故A正确;B、由图象可以看出,反应中X物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物,且△n(X):△n(Y):△n(Z)=0.05mol:0.15mol:0.1mol=1:3:2,25 ℃时,反应可表示为X(g)+3Y(g)![]() 2Z(g),故B正确;C、 增大压强,浓度增大,反应速率增大,故C错误。D、从反应开始到5 min,用Z表示的反应速率为=
2Z(g),故B正确;C、 增大压强,浓度增大,反应速率增大,故C错误。D、从反应开始到5 min,用Z表示的反应速率为=![]() =0.01 mol·L-1·min-1,故D正确;故选C。
=0.01 mol·L-1·min-1,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________,其原因是_____________________。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________(填晶体类型)。
(4)金属铁晶体中原子采用_________堆积,铁晶体的空间利用率为______(用含π的式子表示)。
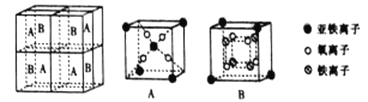
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________(填最简整数比);已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为_______________nm(用含d和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,lmolX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
A. 达到平衡时,3v正(Y)=2v逆(Z)
B. 反应一段时间后,X与Y的转化率之比为1:3
C. X的体积分数不变,说明反应己达到平衡状态
D. 达到平衡后,若从平衡体系中移走部分的Z则v正增大v逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯的说法错误得是( )
A. 其产量可衡量国家的石油化工发展水平B. 不能使酸性高锰酸钾溶液褪色
C. 在工业中用于制作聚乙烯塑料D. 在农业中作植物生长调节剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
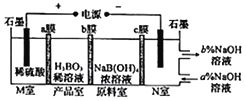
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C16H22O5 B. C14H16O4 C. C16H20O4 D. C14H18O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com