自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
(1)已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ/mol
N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ/mol
2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
.
(2)在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L
-1和b mol?L
-1,反应为:N
2+3H
2?2NH
3,氨气的浓度随时间变化如图1所示.在10min时采取的措施是
,点A的平衡常数K
(填“<”、“>”或“=”)B点的平衡常数.

(3)若合成塔内生成17g氨气放出45.5kJ热量,在图2坐标上画出该合成氨反应过程中能量随时间的变化示意图.
(4)在一定体积的恒容密闭容器中,进行如下化学反应:N
2(g)+3H
2(g)?2NH
3(g),其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K |
4.1×106 |
K1 |
K2 |
… |
①比较K
1、K
2的大小:K
1
K
2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是
(填序号).
A.2v
正(H
2)(正)=3v
逆(NH
3) B.v
正(N
2)=3v
逆(H
2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)在一定温度和催化剂下,将6.4mol H
2和2.4molN
2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH
3.计算该条件下的平衡常数(写出计算过程).
.



 阅读快车系列答案
阅读快车系列答案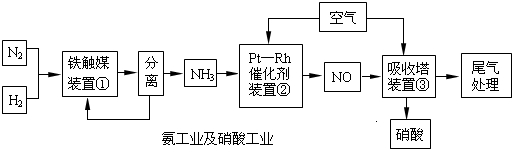
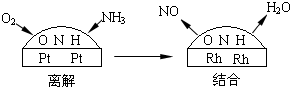
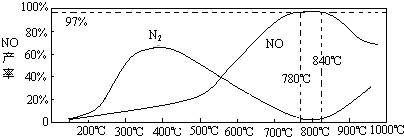

 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.