
【题目】下列图示与对应的叙述相符的是
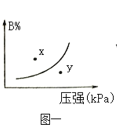

A.图一表示反应:mA(s)+nB(g)![]() pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
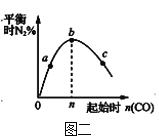
B.图二表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
C.图三表示对于化学反应mA(g)+nB(g)![]() pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D.图四所示图中的阴影部分面积的含义是(v正-v逆)
【答案】A
【解析】
A.由图象可以看出,x点的压强小于y点压强,相同温度下,压强越大,反应速率越大,故x点比y点的反应速率慢,故A正确;
B.NO的物质的量不变,增大CO的物质的量,平衡正向移动,NO的转化率增大,所以NO的转化率c>b>a,故B错误;
C.据图可知随着温度升高,A的百分含量先逐渐下降到最低点,再上升,说明M点之前由于反应速率较慢,测定A的百分含量时反应还未达到平衡,M点之后均为平衡点,则升高温度A的平衡百分含量变大,所以该反应为放热反应,焓变△H<0,故C错误;
D.阴影部分面积为曲边几何图形的面积,对于化学反应速率的定义式,在某时刻的化学反应速率定义为v=![]() ,则阴影部分的面积表示浓度变化量△tv正-△tv逆即[c(反应物)-c(生成物)],而不是v正-v逆,故D错误;
,则阴影部分的面积表示浓度变化量△tv正-△tv逆即[c(反应物)-c(生成物)],而不是v正-v逆,故D错误;
综上所述答案为A。


科目:高中化学 来源: 题型:
【题目】可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为H3PO4,沸点高难挥发)有一定关系。
(1)室温下,测得0.1mol/LH3PO4溶液的pH=1.5,用电离方程式解释原因:__。
(2)长期过量饮用可乐会破坏牙釉质,使下面的平衡向脱矿方向移动,造成龋齿。结合平衡移动原理解释原因:__。
Ca5(PO4)3OH(s)![]() 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO![]() (aq)+OH-(aq)
(aq)+OH-(aq)
(3)向磷酸溶液中滴加NaOH溶液,含磷各微粒在溶液中的物质的量分数与pH的关系如图所示。
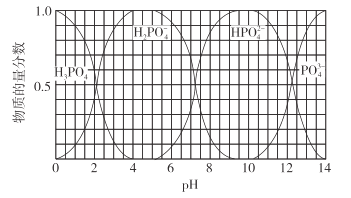
①向磷酸溶液中滴加NaOH溶液至pH=10时发生的主要反应的离子方程式是___。
②下列关于0.1mol/LNa2HPO4溶液的说法正确的是__(填序号)。
a.Na2HPO4溶液显碱性,原因是HPO![]() 的水解程度大于其电离程度
的水解程度大于其电离程度
b.c(Na+)+c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
c.c(Na+)=c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )+c(H3PO4)
)+c(H3PO4)
(4)小组同学在实验室测定某可乐中磷酸的含量(不考虑白砂糖、咖啡因的影响)。
i.将一瓶可乐注入圆底烧瓶,加入活性炭,吸附色素。
ⅱ.将可乐回流加热10min,冷却至室温,过滤。
ⅲ.取50.00mL滤液,用百里香酚酞作指示剂,用0.100mol/LNaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液5.00mL。
①加热的目的是__。
②该可乐样品中磷酸的含量为__g/L(H3PO4摩尔质量为98g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中
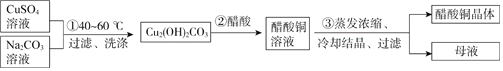
(1)用离子方程式表示过程①产物中OH-的来源:___________;
(2)过程②对应的化学方程式是:___________。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2![]() +I2=
+I2=![]() +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________;
(4)醋酸铜产品中铜元素的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
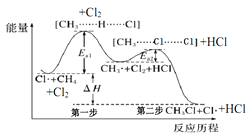
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
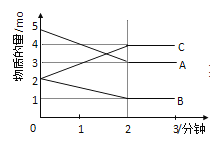
(1)该反应的化学方程式为______________;
(2)恒温恒容下,N2(g)+3H2(g) ![]() 2NH3(g),达到平衡的标志有_______________。
2NH3(g),达到平衡的标志有_______________。
A.3v正(H2)=2v逆(NH3)
B.混合气体总质量不在随时间变化
C.容器内的压强不再随时间而变化
D. N2、H2、NH3的浓度之比为1:2:3
E.单位时间生成nmolN2,同时消耗3nmolH2
F.断开一个N≡N键的同时有6个N—H键生成
Ⅱ:以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:
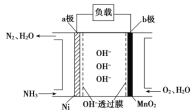
①a极是电池的______________(填“正”或“负”)极,电极反应式为________________。
②当生成0.5molN2时,电路中通过的电子的物质的量为_____。
Ⅲ:甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
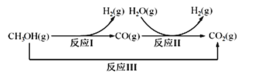
(1)已知一定条件下
反应I: CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是____________________________。
(2)如图,酸性电解质溶液中,电解CO2可以制备乙醇,写出阴极的电极方程式:____________________________。
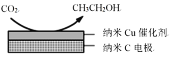
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作及现象 | 结论 |
A | 加入AgNO3溶液,生成白色沉淀,再加稀盐酸沉淀不溶解 | 原溶液中有Cl-存在 |
B | 通入Cl2后,溶液变为深黄色,继续加入淀粉溶液后溶液变蓝 | 原溶液中有I-存在 |
C | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时 | 原溶液中有 |
D | 加入稀盐酸,生成的气体能使澄清石灰水变浑浊 | 原溶液中有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )
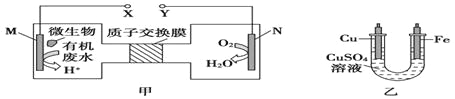
A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
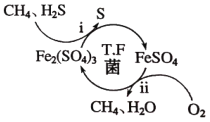
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com