
【题目】芳香族化合物Q的相对分子质量为148,Q既能使溴的四氯化碳溶液褪色,又能与小苏打反应放出气体。下列有关Q的叙述错误的是
A. 分子式为C9H8O2 B. 发生酯化反应
C. 结构简式有5种 D. 分子中所有原子不能处于同一平面
【答案】D
【解析】
A.根据“Q既能使溴的四氯化碳溶液褪色”,说明Q分子中含有>C=C<或-C≡C-结构;根据Q“能与小苏打反应放出气体”可推知Q分子中含有-COOH结构,因为Q是“芳香化合物”故Q分子含苯环,则该分子中至少有9个碳原子和2个氧原子,余下氢原子的个数=148-12×9-16×2=8(该数值小于12说明Q中不可能多1个碳原子或1个氧原子),因此Q分子式为C9H8O2。A项正确;
B.因为Q分子中含有-COOH(羧基),所以Q能与醇发生酯化反应,B项正确;
C. 根据Q的分子式为C9H8O2可知,Q的不饱和度=![]() =6,说明分子中只能含1个苯环、1个>C=C<,1个-COOH,其同分异构体的结构为
=6,说明分子中只能含1个苯环、1个>C=C<,1个-COOH,其同分异构体的结构为![]() ,共5种,C项正确;
,共5种,C项正确;
D.Q分子中苯环平面、>C=C<平面、-COOH平面通过单键相连,因单键可以旋转,所以在Q的5种同分异构体中,都有可能分子中所有原子处于同一平面,D项错误;答案选D。


科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。已知WO3和LiFe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色。下列有关说法不正确的是

A. 当外电流通过1mol电子时,通过离子导体层的Li+数目为NA
B. 为了获得较好的遮光效果,A应该接电源的负极
C. 该电致变色系统在较长时间的使用过程中离子导体层中Li+的量可保持基本不变
D. 当B接电源正极时,离子储存层反应为:Fe4[Fe(CN)6]3+4Li++4e-= Li4Fe4[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为硬脂酸甘油酯在碱性条件下水解的装置图。
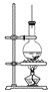
进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入8g硬脂酸甘油酯,然后加入2g氢氧化钠、5mL水和10mL酒精,加入酒精的作用为_____________________________________________。
(2)隔着石棉网给反应物加热约10min,皂化反应基本完成,判断依据是___________,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入__________,静置一段时间后,溶液分为上下两层,肥皂在____层,这个操作称为________。
(4)图中长玻璃导管的作用为______________________________________________________。
(5)日常生活中用热的纯碱溶液来洗涤粘有油脂的器皿的原因是________________________。
(6)这个实验有一个缺点就是容易产生________现象,为避免这种现象工业生产上常用________加热法防止这种现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(其中硅与稀硫酸不反应)测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):A接(_____)(_____)接(_____)

(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?____
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,元素的非金属性最强的是( )
A.原子最外层电子数为次外层电子数的2倍
B.第三周期IIIA族元素
C.第16号元素
D.原子核外L层电子数为K层电子数的三倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用情性电极电解一定浓度的CuSO4溶液,通电—段时间后,向所得的溶液中加入19.6g Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是
A. 电解过程中阴极没有气体生成 B. 电解过程中转移的电子的物质的量为0.6mol
C. 原CuSO4溶液的浓度为0.1 mol·L-1 D. 电解过程中阴、阳极共收集到气体体枳为8.96L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙及其化合物在工业上、建筑工程上和医药上用途很大。回答下列问题
(1)基态Ca原子M能层有_____个运动状态不同的电子,Ca的第一电离能__________(填“大于”或“小于”)Ga。
(2)Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔点沸点等都比金属Ca高,原因是____________________。
(3)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是__________、中心原子的杂化形式为___________。
(4)碳酸盐的热分解示意图如图所示

热分解温度:CaCO3_______ (填“高于”或“低于”)SrCO3,原因是_____________________________。从价键轨道看,CO2分子内的化学键类型有__________。
(5)萤石是唯一一种可以提炼大量氟元素的矿物,晶胞如图所示。Ca2+的配位数为__________,萤石的一个晶胞的离子数为__________,已知晶胞参数为0.545nm,阿伏加德罗常数的值为NA,则萤石的密度为__________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键的叙述正确的是
A. 原子间的强烈的静电作用 B. 阴、阳离子间的强烈的吸引
C. 阴阳离子间强烈的静电作用 D. 阴阳离子键强烈的排斥作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com