
����Ŀ��NaClO�㷺������ɱ����ˮ��������Ư���ȡ�
��֪��NaClO��Һ�����ֲַ���������ҺpH�Ĺ�ϵ��ͼ1��ʾ��
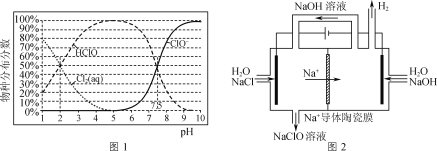
��1����NaClO��Һ��ͨ��CO2��������Ӧ�����ӷ���ʽΪ___(H2CO3��lgKa1��lgKa2����Ϊ-6.38��-10.21)����ӦClO-+H2O![]() HClO+OH-��lgK=____��
HClO+OH-��lgK=____��
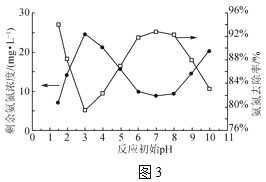
��2����Na+�����մ�Ĥ��ⷨ��������������Һ��װ����ͼ2��ʾ��
����������Cl2�ĵ缫��ӦʽΪ____��
�������������䣬����ȥ��Na+�����մ�Ĥ����NaClO�IJ�����ή�ͣ�����Ҫԭ����___��
��3��NaClO��Һ��ClO-��H2O������ǿ�����Ե�HClO���ɽ�ˮ���а�������ΪN2(NH3��NH![]() ���ױ�����)������ʱ��ȡ������ˮ200mL����ת�١�NaClOͶ������ͬ�Ҿ���Ӧ30minʱ����Ӧ��ʼpH��ʣ�ఱ��Ũ�ȼ�����ȥ���ʵ�Ӱ����ͼ3��ʾ��
���ױ�����)������ʱ��ȡ������ˮ200mL����ת�١�NaClOͶ������ͬ�Ҿ���Ӧ30minʱ����Ӧ��ʼpH��ʣ�ఱ��Ũ�ȼ�����ȥ���ʵ�Ӱ����ͼ3��ʾ��
��NaClO����NH3�Ļ�ѧ����ʽΪ___��
��pH��3��7ʱ����pH����ȥ�������ߵ�ԭ����___��
��pH��7��9ʱ����pH����ȥ���ʽ��͵�ԭ����__��
���𰸡�CO2+ClO-+H2O=HCO![]() +HClO -6.5 2Cl--2e-=Cl2�� ClO-��ɢ������������ԭ 2NH3+3NaClO=N2+3H2O+3NaCl ����ҺpH����NH
+HClO -6.5 2Cl--2e-=Cl2�� ClO-��ɢ������������ԭ 2NH3+3NaClO=N2+3H2O+3NaCl ����ҺpH����NH![]() ��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO NaClO��Һ��ClO-�������������Լ���
��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO NaClO��Һ��ClO-�������������Լ���
��������
��1������ǿ��HClO��HCO3-������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ��������ˮ��ƽ�ⳣ���������㣻
��2����������������ʧ���Ӳ���Cl2��
��ClO-��ɢ������������ԭ������NaClO�IJ�����ή�ͣ�
��3����NaClO����NH3���ɵ�����ͬʱ�����Ȼ��ƺ�ˮ��
�ڢ۸���ͼ����Ϣ������߱仯���з�����
��1������ǿ��HClO��HCO3-������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ����ᣬ���ӷ���ʽΪClO-+CO2+H2O�THClO+HCO3-��
����ͼ����Ϣ��֪��pH=7.5��Ka=c(H+)=10-7.5����ӦClO-+H2O![]() HClO+OH-��K=
HClO+OH-��K=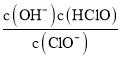 =
=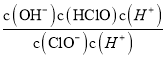 =
=![]() =
=![]() =10-6.5��lgK= lg10-6.5=-6.5��
=10-6.5��lgK= lg10-6.5=-6.5��
��2����������������ʧ���Ӳ���Cl2�������ĵ缫��ӦʽΪ2Cl--2e-=Cl2����
�������������䣬����ȥ��Na+�����մ�Ĥ���� ClO-��ɢ������������ԭ������NaClO�IJ�����ή�ͣ�
��3����NaClO����NH3���ɵ�����ͬʱ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ2NH3+3NaClO=N2+3H2O+3NaCl��
������ҺpH����NH![]() ��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO����pH��3��7ʱ����pH����ȥ�������ߣ�
��ת��Ϊ���ױ�������NH3������ͼ1֪NaClO��Һ����Ҫ�ɷ�Ϊ����������ǿ��HClO����pH��3��7ʱ����pH����ȥ�������ߣ�
��NaClO��Һ��ClO-�������������Լ�������pH��7��9ʱ����pH����ȥ���ʽ��͡�


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���һ�ܱ������г���һ������NH3����Ӧ2NH3(g)![]() N2(g)+3H2(g)�ﵽƽ��ʱN2������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
N2(g)+3H2(g)�ﵽƽ��ʱN2������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. ѹǿ:p1>p2
B. b��c�����Ӧ��ƽ�ⳣ��:Kc>Kb
C. a��:2v(NH3)��=3v(H2)��
D. a��:NH3��ת����Ϊ1/3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������H2C2O4(����)�����ܼ��������ȡ��������(��Ҫ��Fe2O3��FeO��SiO2��)�Ʊ����첢���ո���������淋Ĺ���������ͼ��
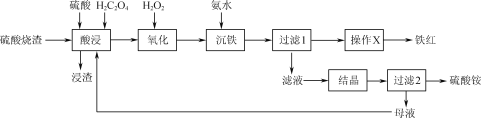
��֪��H2C2O4�ɳ���Ca2+��Fe2+�Ƚ������ӣ�����Fe3+����[Fe(C2O4)3]3-�������������¿��ȷֽ�����CO��CO2��
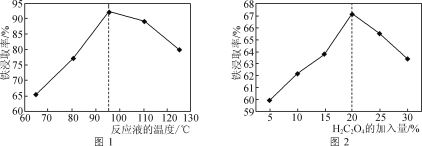
(1)��50%�����ᡰ�����ʱ����ӦҺ���¶ȡ�H2C2O4�ļ�����������ȡ�ʵ�Ӱ��ֱ���ͼ1��ͼ2��ʾ��
�١�������������Fe2O3��H2SO4��Ӧ�Ļ�ѧ����ʽΪ___��
��ͼ1�У���ӦҺ���¶ȸ���95��ʱ������ȡ�ʿ�ʼ���ͣ���ԭ����___��
��ͼ2�У�H2C2O4��������5��20%ʱ������ȡ����������������������ԭ����__��H2C2O4����������20%ʱ������ȡ�ʷ�����ʼ���ͣ���ԭ����___��
(2)��������ʱ��������Ҫ��Ӧ�����ӷ���ʽΪ____��
(3)�ɡ�����1���������Ʊ�����ġ�����X��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2������CH4�ķ�Ӧ��(��)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)����H1��
2CO(g)+2H2(g)����H1��
��Ҫ����Ӧ��(��)H2(g)+CO2(g)![]() CO(g)+H2O(g)����H2>0��
CO(g)+H2O(g)����H2>0��
(��)4H2(g)+CO2(g)![]() CH4(g)+2H2O(g)����H3<0��
CH4(g)+2H2O(g)����H3<0��
�ں��ݷ�Ӧ���а��������V(CH4)��V(CO2)=50%��50%�������壬�����������÷�Ӧ����ƽ��ʱ�����ʵ�����������¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
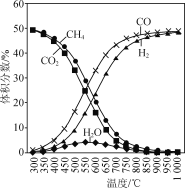
A.��H1=2��H2-��H3<0
B.�����������䣬�ʵ�������ʼʱV(CH4)��V(CO2)�������Ƹ���Ӧ(��)��(��)�Ľ���
C.300��580��ʱ��H2O����������������������ڷ�Ӧ(��)����H2O�������ڷ�Ӧ(��)���ĵ���
D.T��ʱ����2.0L�����м���2mol CH4��2mol CO2�Լ���������������Ӧ�����CO2��ƽ��ת����Ϊ75%����Ӧ(��)��ƽ�ⳣ��С��81
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�㷺����ˮ������ֽ��Ư�ȡ�
��1���Ʊ�ClO2ԭ����NaClO2�ȣ�������ClO2(g)������ˮ���յõ�����ҺA��
��ClO2����Ԫ�صĻ��ϼ�Ϊ___��
��NaClO2��������������������ClO2����(������������Cl2)��д���䷴Ӧ����ClO2��NaCl��ˮ�Ļ�ѧ����ʽ��___��
��2���������ⶨClO2����ҺA��ClO2��Cl2��Ũ�ȵ���Ҫʵ�鲽�����£�
����1.����ƿ�м���50mL����ˮ��25mL100g��L-1KI��Һ(����)���������м���5.00mLClO2����Һ(������Ӧ��2ClO2+2KI=2KClO2+I2��Cl2+2KI=2KCl+I2)��
����2.��0.1000mol��L-1Na2S2O3����Һ�ζ�(2Na2S2O3+I2=2NaI+Na2S4O6)��dz��ɫ���ټ���1mL������Һ�������ζ�����ɫ�պ���ʧ������Na2S2O3��Һ6.00mL��
����3.����2����Һ�м���5mL2mol��L-1������Һ�ữ��������Ӧ��KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O��
����4.�ظ�����2�������ڶ��εζ�������0.1000mol��L-1Na2S2O3��Һ20.00mL��
�����������ݣ�����ClO2����ҺA��ClO2��Cl2��Ũ��___(��λg��L-1��д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��ƵĻ�����˵����ȷ���ǣ�������
A. ��NaOHŨ��Һ�μӵ�����FeCl3��Һ���Ʊ�Fe��OH��3����
B. �ü��ȷ���ȥNaHCO3�����л��е�Na2CO3
C. ���հ�ɫ��ĩ������ʻ�ɫ��֤��ԭ��ĩ����Na+��һ��û��K+
D. Na2O2�����ں����������������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪�ɽ������Ƶ������ƣ����ö��ַ�����a.4Na��O2===2Na2O��b.4Na��CO2===2Na2O��C��c.2NaNO2��6Na===4Na2O��N2����
�����������ַ����У���õķ�����________(�����)��ԭ����________________��
��������Ӧc��NaNO2��________��������1 mol NaNO2��Ӧʱ������ת�Ƶ���Ŀ��________________________________________________________________________��
(2)���ý����ƺͿ����Ʊ����Ƚϸߵ�Na2O2�������õ�װ�����¡��ش���������(ע��Na2O2������H2O��CO2��Ӧ)��
��װ�â���ʢ�ŵ�ҩƷ��________����������____________________________��


�����涨�����������������ң������ʵ��װ��ʱ�������ӿڵı����ĸ(a��b����)˳��������________��________��________��________��________��________��________��
��װ�â������____________________________________________________��
�ܲ�����ͨ�����ͼ��ȵ�˳��Ϊ________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������CuO��Fe2O3��ɵĻ����ag�������м���2 molL��1��������Һ50 mL��ǡ����ȫ��Ӧ������ag�û����������H2�м��ȣ�ʹ���ַ�Ӧ��������ȴ��ʣ���������_________��
��2��ȡһ������CuO��ĩ��0.5 Lϡ�����ַ�Ӧ��һ��50 g��������������Һ�У��������������ٱ仯ʱ����������0.24 g�����ռ���224 mL���壨��״���������CuO��ĩ������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A. (CH3)3C-CH=CH2��������ȫ��Ӧ������2��2��3-��������
B. ��ҵ������ϩ���Ҵ������ƻ���������ڼӳɷ�Ӧ
C. C5H11Cl��ͬ���칹����3��
D.  ����������̼ԭ��һ����ͬһƽ����
����������̼ԭ��һ����ͬһƽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com