
����Ŀ��Ϊ̽峹���X(�������ֳ���������Ԫ��)����ɺ�����,��Ʋ��������ʵ��:

��֪:����A��һ�ִ�����,�ڱ�״���µ��ܶ�Ϊ1.429g/L������B�ǹ��ά����Ҫ�ɷ֡���ش�:
(1)����A���ӵĵ���ʽ_______,��ɫ����D�Ļ�ѧʽ_______��
(2)����X��ϡ���ᷴӦ�����ӷ���ʽ��_______��
(3)��֪NH3������A��һ�������·�Ӧ��ɵõ�һ�������մɲ���(��������Ԫ��,Ħ������Ϊ140g/ mol)��H2,д ���÷�Ӧ �Ļ�ѧ����ʽ_______��
���𰸡� 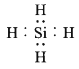 Mg(OH)2 Mg2Si+4H+=2Mg2++SiH4�� 3SiH4+4NH3
Mg(OH)2 Mg2Si+4H+=2Mg2++SiH4�� 3SiH4+4NH3 ![]() Si3N4+12H2
Si3N4+12H2
����������֪����A�ڱ�״���µ��ܶ�Ϊ1.429g��L��1������Ħ������Ϊ1.429g��L��1��22.4L/mol
=32g/mol������B�ǹ��ά����Ҫ�ɷּ�SiO2��6.0gSiO2�����ʵ���Ϊ0.1mol����7.6gX�к�Si������Ϊ2.8g����0.1mol���ڶ����ڽ���Ԫ���У������NaOH��Ӧ���ɰ�ɫ����ֻ��Mg(OH)2���������ʵ���Ϊ0.2mol������7.6gX�к�Mg������Ϊ4.8g����0.2mol���ɴ���֪XΪMg2Si���������ᷴӦ���ɵ�A����ΪSiH4����Ħ������ǡ��Ϊ32g/mol��
(1)SiH4�ĵ���ʽΪ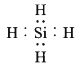 ����ɫ����D�Ļ�ѧʽΪMg(OH)2��
����ɫ����D�Ļ�ѧʽΪMg(OH)2��
(2)����X��ϡ���ᷴӦ�����ӷ���ʽ��Mg2Si+4H+=2Mg2++SiH4����
(3)NH3��SiH4��һ�������·�Ӧ����һ�������մɲ��Ϻ�H2�����������մɲ����к���Si��N����Ԫ�أ����ݶ��ߵĻ��ϼۿ�֪���仯ѧʽΪSi3N4��Ħ������Ϊ140g/ mol�����Է�Ӧ�Ļ�ѧ����ʽΪ3SiH4+4NH3 ![]() Si3N4+12H2��
Si3N4+12H2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̪���ҹ������з���һ���������Ƽ���ȱѪ���������ҩ���ϳɶ���̪(J)��һ��·�����£�


��1��A��������_______________��A�����������_____��ԭ�ӹ�ƽ�档
��2��B����A�Ļ�ѧ����ʽ______________________��
��3��D����E�ķ�Ӧ����Ϊ_________���Լ�a��_________��
��4��F�Ľṹ��ʽ_____________________��
��5��J��һ�����������г����������һ����Ԫ����д��H����J�Ļ�ѧ����ʽ_____��ע����Ӧ��������
��6��![]() ��X��ͬ���칹���У����ܷ���������Ӧ���������Ȼ�����Һ������ɫ��Ӧ����������������X��ͬ���칹�干��______�֣�д�����к˴Ź����������������շ�Ľṹ��ʽ___________________��
��X��ͬ���칹���У����ܷ���������Ӧ���������Ȼ�����Һ������ɫ��Ӧ����������������X��ͬ���칹�干��______�֣�д�����к˴Ź����������������շ�Ľṹ��ʽ___________________��
��7������������Ϣ����ѧ֪ʶ��д���Լ���ͻ�����DΪԭ�ϣ��ϳ� ![]() ��·������ͼ____________________�������Լ���ѡ����
��·������ͼ____________________�������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��TiO2��һ�����������İ뵼������������Ч�������л���Ⱦ�������ȩ���ױ���)�ͺ���������(��NH3��CN������ת��ΪCO2��N2��С�������ʡ�
��1��Ti��̬��������Ų�ʽΪ________________��
��2����ȩHCHO���ӿռ乹��Ϊ_____��������̼ԭ�ӹ���ӻ�����Ϊ_____���м��ͦҼ��ĸ���֮��Ϊ____��
��3��������������ˮ������Ϊ����ˮ�ķ��Ӿ���_________������Ϊ___________��
��4���ױ��������ܹ���ƽ���ԭ�����Ϊ____�����������ױ�±�ؼӳɣ����Ƚ����ױ�±��ȡ�������ϵ��⣬ԭ����___________________��
��5����CN������ˮ���Լ�������NaClO�Ȱ�CN������ΪCNO����Ȼ���������������ٽ�CNO������Ϊ����Ⱦ�����塣��д����CNO����Ϊ�ȵ��������______���ӻ����ӣ�дһ�֣���
��6��Ti[(CN)4]2-��Ti2+��CN-��Cԭ���γ���λ���������ǿռ乹�ͣ�Ti[(CN)4]2-�Ľṹ�ɱ�ʾΪ_____________________��
��7��Ti��ij�������CaO��������γ������εľ����ṹ��ͼ��ʾ��Ti4+λ��������Ķ��㣬Ca2+ ��������������ģ����þ����У�Ti4+����Χ____ ��O2-����ڣ����þ������ܶ�Ϊdg/cm3���������ļ���Ϊ______pm ���ô�NA�Ĵ���ʽ��ʾ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӿ�������Һ�д���������ǣ� ��
A.K+��Mg2+��SO42����OH��
B.Na+��H+��Cl����HCO3��
C.K+��Ag+��NO3����Cl��
D.K+��Cu2+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ���ڴ����Ĵ����¿ɷ���ż����Ӧ����ΪGlaser��Ӧ��
2R��C��C��H![]() R��C��C��C��C��R��H2
R��C��C��C��C��R��H2
�÷�Ӧ���о����ͷ�����ϡ������ӻ�ѧ�ȷ��������Ҫ��ֵ������������Glaser��Ӧ�ɱ�A�Ʊ�������E��һ�ֺϳ�·�ߣ�


�ش��������⣺
��1��B�Ľṹ��ʽΪ________��D�Ļ�ѧ����Ϊ________��
��2���ٺ͢۵ķ�Ӧ���ͷֱ�Ϊ________��________��
��3��E�Ľṹ��ʽΪ____________________��1 mol E��������Ӧ�������������������________ mol��
��4�����㻯����F��C��ͬ���칹�壬�������ֻ�����ֲ�ͬ��ѧ�������⣬��Ŀ��Ϊ3��1�������������ͬ���칹����______�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�������Ԫ�����Ͻ������½�Ԫ���������ƣ���Be��Al��B��Si��������������˵���������
A.BeO�����Ի�����B.Li2CO3��LiOH��������ˮ
C.1molBe��NaOH��Һ��Ӧ������1molH2D.��֪Si�۷е����B�۷е�Ҳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������мȺ������Ӽ��ֺ��й��ۼ����ǵ���
A.HClB.KClC.H2SO4D.NH4NO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�Na2S2O3��5H2O�����������մ��ֳ�Ϊ������������������ˮ���������Ҵ������ȡ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ�����ͼ��
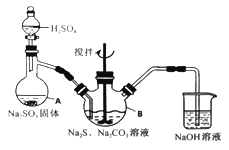
ʵ������������Ϊ��
�ٿ�����Һ©����ʹ�����������£��ʵ����ڷ�Һ�ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ��С�
��ֱ�������Ļ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨ��SO2���塣
����
��1�������A������_______��
��2��Ϊ�˱�֤��������ƵIJ�����ʵ���в�������ҺpH <7���������ӷ���ʽ����ԭ��_________��
��3��д��������ƿB����ȡNa2S2O3����Ӧ���ܻ�ѧ��Ӧ����ʽ________��
��4����������������Һ�л�ýϸ߲���Na2S2O3��5H2O�IJ���Ϊ

Ϊ���ٲ�Ʒ����ʧ��������Ϊ���ȹ��ˣ�����������ԭ����______����������______���������dz��ˡ�ϴ�ӡ����
��5���ⶨ��Ʒ����
ȡ6.00g��Ʒ�����Ƴ�100mL��Һ��ȡ10.00mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0.500mol/LI2�ı���Һ���еζ�����Ӧԭ��Ϊ2S2O32-+I2=S4O62-+2I-��������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.98 | 22.50 | 20.02 |
�ζ�ʱ���ﵽ�ζ��յ��������___________����Ʒ�Ĵ���Ϊ____________��
��6��Na2S2O3������������������Һ���ױ�Cl2������SO42-���÷�Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ��ʳ��ˮ��Һ�з���õ�ʳ�ι���ɲ��õ�ʵ������ǣ� ��
A.��Һ
B.����
C.����
D.����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com