
【题目】从宏观现象探究微观本质是重要的化学学科素养。以亚硫酸纳(Na2SO3)为实验对象,探究其性质。实验如下:
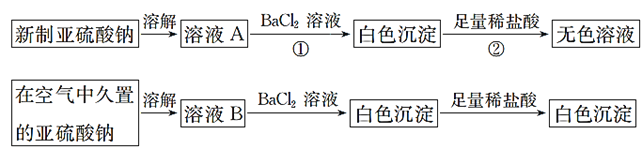
(1)写出上述实验中②的离子方程式:__________。
(2)通过上述实验可知,在空气中久置的亚硫酸纳固体中会混有____________ (填化学式)。
(3)亚硫酸纳晶体样品若变质,下列说法错误的是 _______________。
A.晶体表面变黄 B.其水溶液pH 将减小 C.其样品质量将增加
(4)将碳酸纳溶液加热到40 ℃通入二氧化硫饱和后,再加入等量的碳酸钠溶液,在避免与空气接触的情况下结晶可制得亚硫酸钠,该制备过程总反应的化学方程式 ___________。
【答案】BaSO3+2H+=Ba2++SO2+H2O Na2SO4 A Na2CO3+SO2=Na2SO3+CO2
【解析】
新制亚硫酸钠溶解得到溶液A,加入氯化钡溶液生成亚硫酸钡白色沉淀,加入足量稀盐酸沉淀溶解得到氯化钡溶液,在空气中久置的亚硫酸钠被空气部分氧化,溶解得到溶液B加入氯化钡溶液生成白色沉淀,加入足量稀盐酸沉淀部分溶解,亚硫酸钠部分被氧化成硫酸钠,据此回答问题。
(1)由分析可知,②反应的离子方程式BaSO3+2H+=Ba2++SO2+H2O,
故答案为:BaSO3+2H+=Ba2++SO2+H2O;
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有Na2SO4,
故答案为:Na2SO4;
(3)A.亚硫酸钠固体是白色晶体,硫酸钠也是白色晶体,不会变黄,故A错误,符合题意;
B.亚硫酸钠溶液中亚硫酸根离子水解使溶液显碱性,氧化成硫酸钠后,溶液显中性,亚硫酸钠部分氧化后其溶液pH值降低,故B正确,不符合题意;
C.亚硫酸钠被氧化成硫酸钠的过程吸收氧气,固体质量增加,故C正确,不符合题意;
故选:A。
(4) 二氧化硫的水溶液具有中等强度酸性,二氧化碳的水溶液酸性较弱,这说明亚硫酸的酸性强于碳酸,强酸能制取弱酸,所以反应方程式为Na2CO3+SO2=Na2SO3+CO2 ,
故答案为:Na2CO3+SO2=Na2SO3+CO2。


科目:高中化学 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
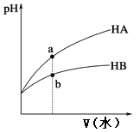
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2SO3水溶液中存在电离平衡H2SO3![]() H++ HSO3- 和HSO3-
H++ HSO3- 和HSO3-![]() H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
H++ SO32-,若对H2SO3溶液进行如下操作,则结论正确的是:( )
A.通入氯气,溶液中氢离子浓度增大
B.通入过量H2S,反应后溶液pH减小
C.加入氢氧化钠溶液,平衡向右移动,pH变小
D.加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳和碳的化合物的结构和性质中
(1)和碳同一主族的硅原子中能量最高的电子处在______电子层上(填写电子层符号),最外层有___种运动状态不同的电子,碳原子核外有______种能量不同的电子,有______种不同形状的电子云.
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是_________
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是________
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液______(填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:______.
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法错误的是( )
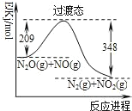
A.使用催化剂可以降低过渡态的能量
B.反应物总能量大于生成物总能量
C.反应的热化学方程式为N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ
D.使用催化剂可提高N2O和NO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
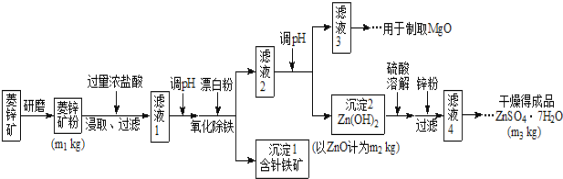
(1)将菱锌矿研磨成粉的目的是_______________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________(选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
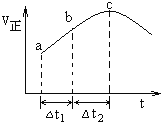
A. 反应在c点达到平衡状态
B. △t1=△t2时,SO2的转化率:a~b段小于b~c段
C. 反应物浓度:a点小于b点
D. 反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com