
【题目】A.为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是_________。
(4)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:
_____KMnO4+____H2SO4+____H2C2O4 = ____MnSO4+_____K2SO4 +____CO2↑+____H2O
【答案】 MnO2+4H++2Cl-
MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 1:2 2 3 5 2 1 10 8
Mn2++Cl2↑+2H2O 1:2 2 3 5 2 1 10 8
【解析】
在浓盐酸与二氧化锰反应中,二氧化锰中的锰元素由+4价降低到+2价,浓盐酸中的氯元素由-1价升高到0价,同时有氯化锰生成,故浓盐酸部分被氧化。假设反应中有1 mol氯气生成,则失去2 mol电子,被氧化的浓盐酸为2 mol,该部分浓盐酸做还原剂;在草酸能使酸性KMnO4溶液反应中,KMnO4![]() MnSO4,锰元素化合价由+7价降低到+2价,H2C2O4
MnSO4,锰元素化合价由+7价降低到+2价,H2C2O4![]() CO2,碳元素由+3价升高到+4价,再结合电子守恒和原子守恒规律配平该氧化还原反应,据此分析作答。
CO2,碳元素由+3价升高到+4价,再结合电子守恒和原子守恒规律配平该氧化还原反应,据此分析作答。
(1)在浓盐酸与二氧化锰反应中,二氧化锰中的锰元素由+4价降低到+2价,得到2个电子被还原;浓盐酸中的氯元素由-1价升高到0价,被氧化,失去电子,故用双线桥法表示电子转移的数目与方向为: ,
,
故答案为: ;
;
(2)在离子方程式中,固体、气体,纯液体要保留化学式,不可拆,则上述制备氯气的反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)MnO2化合价降低,做氧化剂,浓盐酸在上述反应中部分起还原剂作用,部分生成了氯化锰,显酸性。根据上述双线桥法分析,按照电子守恒规律可知,MnO2![]() 2e-
2e-![]() MnCl2,
MnCl2,![]() 2HCl
2HCl![]() 2e-
2e-![]() Cl2,所以该反应中,氧化剂和还原剂之比是1:2,
Cl2,所以该反应中,氧化剂和还原剂之比是1:2,
故答案为:1:2;
(4)在草酸能使酸性KMnO4溶液反应中,KMnO4![]() MnSO4,锰元素化合价降低(+7)-(+2)=5价,H2C2O4
MnSO4,锰元素化合价降低(+7)-(+2)=5价,H2C2O4![]() CO2,碳元素化合价升高(+4)-(+3)=1价,根据电子守恒及原子守恒规律,配平该反应为:2 KMnO4 + 3 H2SO4 + 5 H2C2O4 = 2 MnSO4 + K2SO4 +10 CO2↑ + 8 H2O,
CO2,碳元素化合价升高(+4)-(+3)=1价,根据电子守恒及原子守恒规律,配平该反应为:2 KMnO4 + 3 H2SO4 + 5 H2C2O4 = 2 MnSO4 + K2SO4 +10 CO2↑ + 8 H2O,
故答案为:2;3;5;2;1;10;8;


科目:高中化学 来源: 题型:
【题目】下表列出了A~R九种元素在周期表的位置:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式____________。
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是_________________ (填化学式)
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为 __________________(用元素的离子符号表示)
(4)写出A的单质与水反应的化学方程式____________________
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g。X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应。
X的元符号是_______________,它位于元素周期表中______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________,为了提高浸出率,可采取的措施是__________________(写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________,__________________。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以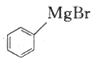 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,用甲酸提供氢气的燃料电池由瑞士科技工作者开发成功。燃料电池包括两个部分:甲(HYFORM)中使用钌(Ru)基催化剂从甲酸中产生氢气;乙(PEMFC)是以NaOH为电解质的氢氧燃料电池。装置的原理示意图如图。下列有关说法错误的是( )

A. 该燃料电池使用的甲酸比氢气更易储存和运输
B. Y室的电极反应式:O2+4H++4e-=2H2O
C. X室为负极室,Y室为正极室
D. 甲中消耗1mol甲酸,乙中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种物质AC2、B2C2、AD4,元素A在自然界中形成的物质种类最多;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子的电子层结构与氩原子相同,则:
(1)A、B、C、D的元素名称分别是________、________、________、________。
(2)AD4分子中含有的共价键类型为________(填“σ键”或“π键”)。
(3)D的负一价阴离子的电子排布式为________,B2C2的电子式为________,属________(填“离子化合物”或“共价化合物”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为中符合安全要求的是
A.进入煤矿井时,用火把照明B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.节日期间,在开阔地燃放烟花爆竹D.在实验时,将水倒入浓硫酸中进行稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com