
【题目】我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________,为了提高浸出率,可采取的措施是__________________(写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________,__________________。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________。[已知:Ksp(MnS)=1.4×10-15]
【答案】 UO3+H2SO4==UO2SO4+ H2O 搅拌、适当提高温度、适当增大酸的浓度等 MnO2+2Fe2++4 H+== Mn2++2Fe3++2H2O 2Fe3++UO2== 2Fe2++ UO22+ 0.018~0.036mol/L UO3+3Na2CO3+ H2O==Na4 [UO2(CO3)3]+2NaOH NaCN+H2S=HCN+NaHS 6
【解析】(1)可用酸性浸出剂硫酸把UO3转化成铀氧基离子UO22+的化合物,所以硫酸酸浸出时的化学方程式为:UO3+H2SO4==UO2SO4+ H2O。根据加快化学反应速率的因素进行解答。为了提高浸出率,可采取的措施是搅拌、适当提高温度、适当增大酸的浓度等方法。
(2)MnO2的作用是在酸性条件下将Fe2+氧化成Fe3+,其反应的离子方程式为:MnO2+2Fe2++4 H+= Mn2++2Fe3++2H2O,生成的Fe3+又将UO2氧化形成UO22+,其反应的离子方程式为:2Fe3++UO2=2Fe2++ UO22+。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,Fe3+的浓度分别为 1g/56g.L-1=0.018mol.L-1, 2g/56g.L-1=0.036mol.L-1.所以此时Fe3+的物质的量浓度范围相当于0.018~0.036mol/L。答案: MnO2+2Fe2++4 H+== Mn2++2Fe3++2H2O 2Fe3++UO2== 2Fe2++ UO22+ 0.018~0.036mol/L
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,其浸出的化学反应方程式为:UO3+3Na2CO3+ H2O==Na4 [UO2(CO3)3]+2NaOH 。
(4)因为HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,所以向NaCN溶液中通入少量的H2S气体,反应的化学方程式为NaCN+H2S=HCN+NaHS。因为MnS = Mn2++S2- Ksp(MnS)=1.4×10-15 所以当Mn2+为0.0020 mol·L-1开始沉淀时c(S2-)=7×10-13,根据Ka2=7.0×10-15,HS-浓度为1.0×10-4 mol·L―1时,c(H+)=1.0×10-6 mol·L―1
所以PH=-lgc(H+)=- lg1.0×10-6=6.。答案:NaCN+H2S=HCN+NaHS 6


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】如下图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
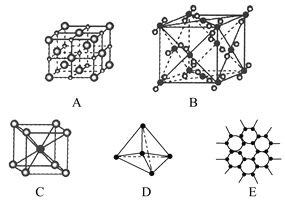
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是_______,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在化学中,常用一条短线表示一个化学键,如下图所示的物质结构中,虚线表示化学键或分子间作用力的是________。

(2)已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________________,结构式________________。
②立体构型为________________。
③中心原子采取________________杂化。
④PH3分子中的化学键____________(填“有”或“无”)极性,其分子为____________(填“极性”或“非极性”)分子。
⑤PH3与NH3的热稳定性:____________更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是比较过氧化钠和氧化钠性质异同的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠是一种碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是_________。
(4)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:
_____KMnO4+____H2SO4+____H2C2O4 = ____MnSO4+_____K2SO4 +____CO2↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“青蒿一握,以水二升渍,绞取汁”诗句中体现的屠呦呦对青蒿素的提取属于化学变化
D.“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及到化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”“摩尔”和“摩尔质量”的叙述正确的是( )
A.“物质的量”是国际单位制中的个基本单位
B.1mol任何物质均约含有6.02×1023个分子
C.物质的摩尔质量等于其相对分子质量或相对原子质量
D.0.012kg12C中所含的碱原子数为NA(NA代表阿伏加德罗常数的数值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com