
【题目】对SO3的说法正确的是( )
A. 结构与NH3相似 B. 结构与SO2相似
C. 结构与BF3相似 D. 结构与P4相似
【答案】C
【解析】三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+![]() ×(6-3×2)=3,且不含孤电子对,所以为平面三角形结构。A.氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
×(6-3×2)=3,且不含孤电子对,所以为平面三角形结构。A.氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+![]() ×(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形,选项A错误;B.SO2分子中,S原子形成2个δ键,孤对电子数为
×(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形,选项A错误;B.SO2分子中,S原子形成2个δ键,孤对电子数为![]() ×(6-2×2)=1,价层电子对个数=σ键个数+孤电子对个数=1+2=3,且含有一个孤电子对,所以立体构型为V型,选项B错误;C.BF3分子中心原子硼原子价层电子对个数=
×(6-2×2)=1,价层电子对个数=σ键个数+孤电子对个数=1+2=3,且含有一个孤电子对,所以立体构型为V型,选项B错误;C.BF3分子中心原子硼原子价层电子对个数=![]() =3,无孤电子对,分子空间构型为平面三角形,三氧化硫分子为平面三角形结构,选项C正确;D.白磷(P4)属于单质,属于分子晶体,立体构型为正四面体型,三氧化硫分子为平面三角形结构,选项D错误;答案选C。
=3,无孤电子对,分子空间构型为平面三角形,三氧化硫分子为平面三角形结构,选项C正确;D.白磷(P4)属于单质,属于分子晶体,立体构型为正四面体型,三氧化硫分子为平面三角形结构,选项D错误;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为__________________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释___________________________。
(3)GaAs熔点1238℃,难溶于溶剂。其晶体类型为_____________。
(4)AsF3的空间构型是:______________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为________。
②[B(OH)4]-的结构式为____________________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅:若将金刚石晶体中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______________________(用化学式表示)。
②立方氮化硼(BN)晶体的结构与金刚石相似,硬度与金刚石相当,立方氮化硼的密度是ρ g·㎝-3,,则晶胞边长为___________。(只要求列算式,不必计算出数值,阿伏伽徳罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得不同物质中O—O键的键长和键能数据如下表。其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。
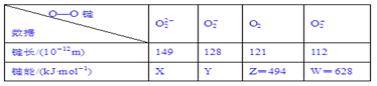
(1)键长与键能的关系规律是_________________________________________。
(2)键长与电子总数的关系规律是______________________________________。
(3)键能与电子总数的关系规律是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,某二元弱酸H2A溶液中离子浓度与pH的关系如图所示(y为lg [c(HA)/c(H2A)]或lg [c(A2)/c(H2A)]):下列说法不正确的是

A. 曲线b为lg[c(HA)/c(H2A)] 与pH的变化关系
B. 该温度下,H2A的Ka2约为104.1
C. 若在上图中作lg[c(HA) /c(A2)] ~ pH关系图,得到的曲线会与曲线b平行
D. 若升高温度,则图中曲线a、b上移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________,为了提高浸出率,可采取的措施是__________________(写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________,__________________。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,用甲酸提供氢气的燃料电池由瑞士科技工作者开发成功。燃料电池包括两个部分:甲(HYFORM)中使用钌(Ru)基催化剂从甲酸中产生氢气;乙(PEMFC)是以NaOH为电解质的氢氧燃料电池。装置的原理示意图如图。下列有关说法错误的是( )

A. 该燃料电池使用的甲酸比氢气更易储存和运输
B. Y室的电极反应式:O2+4H++4e-=2H2O
C. X室为负极室,Y室为正极室
D. 甲中消耗1mol甲酸,乙中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
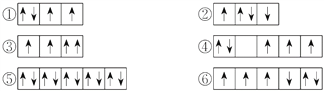
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】试题分析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
解析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。
【题型】综合题
【结束】
18
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com