
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为__________________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释___________________________。
(3)GaAs熔点1238℃,难溶于溶剂。其晶体类型为_____________。
(4)AsF3的空间构型是:______________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为________。
②[B(OH)4]-的结构式为____________________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅:若将金刚石晶体中一半的碳原子換成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_______________________(用化学式表示)。
②立方氮化硼(BN)晶体的结构与金刚石相似,硬度与金刚石相当,立方氮化硼的密度是ρ g·㎝-3,,则晶胞边长为___________。(只要求列算式,不必计算出数值,阿伏伽徳罗常数为NA)。
【答案】 3d10 砷的4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大原子晶体 原子晶体 三角锥形 sp3杂化 略 C>SiC>Si ![]()
![]()
【解析】(1)铜的原子序数为29,失去最外层一个电子形成Cu+,则Cu+在基态时的价电子排布式为:3d10。
(2)砷的价电子排布式4s24p3、硒的价电子排布式4s24p4,砷原子4p上电子是半充满,更加稳定,失电子困难,砷的第一电离能比硒的第一电离能大。
(3)GaAs熔点1238℃,难溶于溶剂,符合原子晶体的特性,故GaAs是原子晶体。
(4)由价层电子对互斥理论可知,n=(5+3)/2=4,As原子采取sp3杂化,而配原子(F)数为3,则AsF3的空间构型是:三角锥形 。
(5)① B是第二周期原子,只有s、p四个轨道,而[B(OH)4]-中有四个OH配体,则B原子采取sp3杂化。
② [B(OH)4]-的结构式为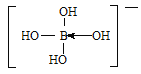 。
。
(6)①金刚石、晶体硅、碳化硅都是原子晶体,原子晶体中共价键的键能越大,晶体熔点越高,而键长越长键能越小,故金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是C>SiC>Si;②根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8/8+6/2+4=8,因此一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为25g×4/ NA,密度=ZMr/NAa3(Z是晶胞含有的单位数,a为晶胞边长),ρ=25g×4/ NA a3,a=![]() pm。
pm。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】化学科技工作者对含有碳杂质的金属铝的腐蚀与溶液酸碱性的关系进行了研究,在25℃时得出溶液pH值对铝的腐蚀影响关系如图所示,下列说法正确的是( )
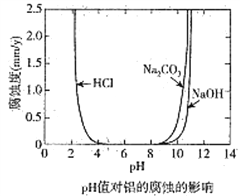
A. 金属铝在浓硫酸中的腐蚀速率大于盐酸中的腐蚀速率
B. 金属铝在中性环境中不易被腐蚀
C. 金属铝在pH=8.5的Na2CO3溶液中会发生电化学腐蚀析出氧气
D. 不能用电解的方法在金属铝的表面生成致密的氧化物薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的电负性从大到小依次为________。
(2)在生成物中,A的晶体类型为________,含极性共价键的分子的中心原子轨道杂化类型为________。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H+、I-、Br2、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
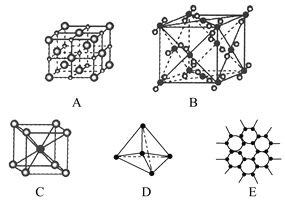
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是_______,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com