
【题目】下面是比较过氧化钠和氧化钠性质异同的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠是一种碱性氧化物
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO.下列叙述正确的是( )
2AlN+3CO.下列叙述正确的是( )
A. 氮化铝中氮元素的化合价为+3
B. AlN的摩尔质量为41g
C. 上述反应中每生成1molAlN,N2就得到3 mol电子
D. 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,某二元弱酸H2A溶液中离子浓度与pH的关系如图所示(y为lg [c(HA)/c(H2A)]或lg [c(A2)/c(H2A)]):下列说法不正确的是

A. 曲线b为lg[c(HA)/c(H2A)] 与pH的变化关系
B. 该温度下,H2A的Ka2约为104.1
C. 若在上图中作lg[c(HA) /c(A2)] ~ pH关系图,得到的曲线会与曲线b平行
D. 若升高温度,则图中曲线a、b上移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A.Na2CO3是氧化物B.Na2CO3是盐
C.Na2CO3是钠盐D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________,为了提高浸出率,可采取的措施是__________________(写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________,__________________。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.凡是能电离出H+的化合物均属于酸
B.由一种元素组成的物质一定是单质
C.纯碱从物质的分类看不属于碱
D.盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种元素的原子电子层结构如下:
A.1s22s22p63s23p63d54s1;B.1s22s22p63s2;C.1s22s22p6;D.1s22s22p63s23p;E.[Ar]4s1。试回答:
(1)哪个式子是错误的________,它违背了________。
(2)哪个式子表示稀有气体原子________。
(3)A的元素符号是________,写出其价电子排布的轨道表示式________。
(4)B和E的金属性强弱关系为________(用元素符号表示),可以说明这一事实的依据是(写出2点)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
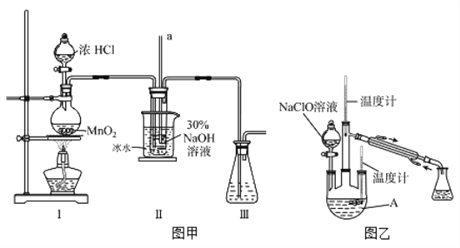
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com