
【题目】(1)在化学中,常用一条短线表示一个化学键,如下图所示的物质结构中,虚线表示化学键或分子间作用力的是________。

(2)已知PH3与NH3结构相似,回答下列问题:
①PH3的电子式________________,结构式________________。
②立体构型为________________。
③中心原子采取________________杂化。
④PH3分子中的化学键____________(填“有”或“无”)极性,其分子为____________(填“极性”或“非极性”)分子。
⑤PH3与NH3的热稳定性:____________更强。
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】根据题目信息完成下列方程式。
(1)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:____________________________________________;
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:____________________________________________。
(2)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.H+、ClO-、Cl-、SO42-B.Na+、H+、CO32-、NO3-
C.Na+、H+、Cl-、NO3-D.K+、H+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得不同物质中O—O键的键长和键能数据如下表。其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。
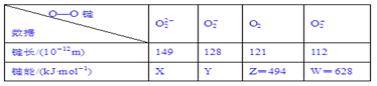
(1)键长与键能的关系规律是_________________________________________。
(2)键长与电子总数的关系规律是______________________________________。
(3)键能与电子总数的关系规律是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,某二元弱酸H2A溶液中离子浓度与pH的关系如图所示(y为lg [c(HA)/c(H2A)]或lg [c(A2)/c(H2A)]):下列说法不正确的是

A. 曲线b为lg[c(HA)/c(H2A)] 与pH的变化关系
B. 该温度下,H2A的Ka2约为104.1
C. 若在上图中作lg[c(HA) /c(A2)] ~ pH关系图,得到的曲线会与曲线b平行
D. 若升高温度,则图中曲线a、b上移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国核电技术居于世界前列。从铀矿石中提取核燃料的过程中,UO3可用酸性浸出剂或碱性浸出剂转化成铀氧基离子UO22+的化合物。

(1)写出硫酸酸浸时的化学方程式__________________________,为了提高浸出率,可采取的措施是__________________(写两条)。
(2)MnO2的作用是在酸性条件下将Fe3+氧化UO2形成的Fe2+迅速氧化成Fe3+,使Fe3+继续氧化UO2。写出这两步的离子方程式__________________,__________________。当溶液中Fe3+的浓度达到1~2g/L时就能有效地溶解UO2,此时Fe3+的物质的量浓度范围相当于______________。
(3)UO3用碳酸钠溶液碱法浸取时生成[UO2(CO3)3]4-离子,写出该浸出化学反应方程式_________________________________。
(4)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15,向NaCN溶液中通入少量的H2S气体,反应的化学方程式为_________________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含Mn2+为0.0020 mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L―1时,Mn2+开始沉淀,则a=__________。[已知:Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
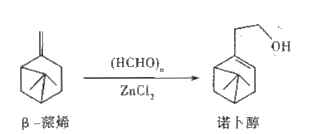
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com