
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
c(N
| ||
| c(OH-) |
| 1 |
| 10 |
| 6-x |
| 12+2x |
| [CO]2?[H2]2 |
| [CO2]?[CH4] |
| 22×22 |
| 0.5×0.5 |
| c2(CO)?c2(H2) |
| c(CO2)?c(CH4) |
| 42×32 |
| 1×2 |
| x |
| 0.5-x |
| 3 |
| 1 |
| 0.375 |
| 0.5 |
| 1 |
| 10 |


科目:高中化学 来源: 题型:
| A、KclO3和SO3溶于水后溶液都能导电,故KClO3和SO3均为电解质 |
| B、向氨水中加入少量NH4Cl固体,pH增大 |
| C、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D、AgCl易转化为Agl沉淀,是因为Ksp(Agl)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中形成的分散系属于悬浊液 |
| B、分子直径比Na+小 |
| C、在水中形成的分散系属于胶体 |
| D、“钴酞菁”分子既能透过滤纸,也能透过半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验燃尽的火柴头浸泡液中含有氯元素ClO3-+3NO2-+Ag+═AgCl↓+3NO3- |
| B、用淀粉碘化钾溶液和醋酸鉴别真假碘盐:IO3-+5I-+6H+=3I2+3H2O |
| C、用纸层析法分离Fe3+和Cu2+时,最后阶段充分氨熏:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+ |
| D、在硫酸亚铁溶液中加入等物质的量的硫酸铵,制备摩尔盐FeSO4+(NH4)2SO4+6H2O═(NH4)2SO4?FeSO4?6H2O↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
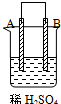 | 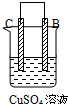 |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、1molFe与过量的稀HNO3反应,转移的电子数为2 NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,l L 0.50 mol?L-1NH4C1溶液与2 L0.25mol?L-1NH4C1溶液NH4+的离子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | X | Y | Z | W |  |
| ① | CuO | Cu(OH)2 | CuSO4 | Cu | |
| ② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
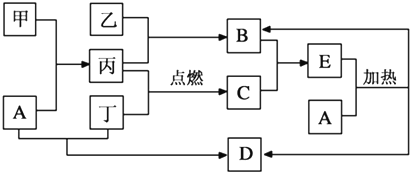
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCl2与足量的铁反应,转移电子数为3NA |
| B、常温常压下,1mol氦气含有的原子数为NA |
| C、标准状况下,2.24L丁烷分子所含的C-H 键数为NA |
| D、1molNa2O2所含的阴离子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com