
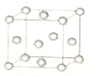
 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.分析 (1)①根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
②氨水溶液中含N、O、H三种元素,氢的电负性最小,又同周期自左而右电负性增大,据此判断;
③醋酸分子中的两个碳原子,甲基(-CH3)碳采用sp2杂化,羧基(-COOH)碳采用sp2杂化;
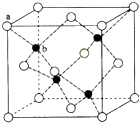
④根据[Cu(NH3)3CO]Ac的结构判断存在的化学键类型;
(2)①计算铜原子的总体积与晶胞总体积的比值;
②晶胞中含有4个铜原子,则晶胞质量为$\frac{4×64}{{N}_{A}}$g,该晶胞体积为a3cm3,带入$ρ=\frac{m}{V}$计算.
解答 解:(1)①Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:[Ar]3d104s1,
故答案为:[Ar]3d104s1;
②氨水溶液中含N、O、H三种元素,氢的电负性最小,又同周期自左而右电负性增大,故负性从大到小的排列顺序为O>N>H,
故答案为:O>N>H;
③醋酸分子中的两个碳原子,甲基(-CH3)碳采用sp2杂化,羧基(-COOH)碳采用sp2杂化,
故答案为:sp3、sp2;
④Cu2+与NH3存在配位键,NH3中N与H形成σ键,[Cu(NH3)3CO]+与Ac-之间是离子键,Ac-内有碳氧双键,所以还有π键,即存在的化学键类型为:配位键、σ键、π键和离子键,
故选abcd;
(2)①该晶胞为面心立方,则晶胞面对角线为铜原子半径的4倍,则铜原子半径为$\frac{\sqrt{2}a}{4}$cm,则铜原子总体积为4×$\frac{4π}{3}$×($\frac{\sqrt{2}a}{4}$)3=0.24πa3cm3,晶胞体积为a3cm3,故空间利用率为$\frac{0.24πa{\;}^{3}}{a{\;}^{3}}$=74%,
故答案为:74%;
②晶胞中含有4个铜原子,则晶胞质量为$\frac{4×64}{{N}_{A}}$g,该晶胞体积为a3cm3,则密度ρ=$\frac{4×64}{{N}_{A}a{\;}^{3}}$=$\frac{256}{{a}^{3}N{\;}_{A}}$g/cm3,
故答案为:$\frac{256}{{a}^{3}N{\;}_{A}}$.
点评 本题考查核外电子排布式、电负性、杂化类型的判断、化学键与晶体结构、晶胞的计算等知识,是对所学知识的综合考查与运用,难度较大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结 论 |
| A | 将盐酸滴入Na2CO3溶液中 | 有气泡产生 | 盐酸的酸性强于碳酸,故;氯的非金属性比碳强 |
| B | 在0.1mol•L-1的NaHCO3溶液中加2滴酚酞,微热 | 溶液颜色由浅红色逐渐加深 | 盐类的水解反应是吸热反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨气呈碱性 |
| D | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(甲):c(乙)=1:10 | B. | c(H+)甲:c(H+)乙=1:2 | ||
| C. | c(OH-)甲:c(OH-)乙=10:1 | D. | a(甲):a(乙)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.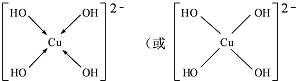 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.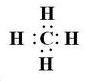 ,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.
,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
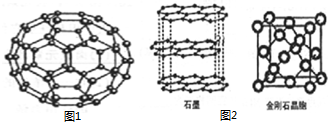 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com