
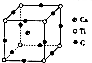
 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.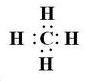 ,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.
,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.分析 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,则A位于ⅠA族,B元素的原子价电子排布为ns2np2,B位于ⅣA族,C元素位于第二周期且原子中p亚层与s亚层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的L电子层的p亚层中有3个电子,则D元素原子电子排布式为1s22s22p3,故D为N元素,
(1)氧原子核外电子数为8,根据核外电子排布规律书写;
A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;
(2)当n=2时,B为碳元素,其简单氢化物为CH4;根据C原子所成σ键数目,确定杂化方式;CO2为直线型结构,分子中正负电荷中心重合;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于O元素,非金属性越强第一电离能越大;
(4)以顶点Ti原子进行研究,该晶体中每个钛原子周围与它最近且距离相等的钙离子位于面心,而每个顶点为8个晶胞共用;根据均摊法计算晶胞中Ca、Ti、O原子数目,进而确定化学式.
解答 解:短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,则A位于ⅠA族,B元素的原子价电子排布为ns2np2,B位于ⅣA族,C元素位于第二周期且原子中p亚层与s亚层电子总数相等,其原子电子排布式为1s22s22p4,故C为氧元素;D元素原子的L电子层的p亚层中有3个电子,则D元素原子电子排布式为1s22s22p3,故D为N元素,
(1)C为氧元素,氧原子核外电子数为8,价电子排布为2s22p4;
A元素的原子最外层电子排布为ms1,A位于ⅠA族,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,
故答案为:2s22p4;σ;
(2)当n=2时,B为碳元素,其简单氢化物为CH4,为正四面体结构,电子式为;C原子成4个σ键、没有孤对电子,故C原子采取sp3杂化方式;CO2为直线型结构,分子中正负电荷中心重合,属于非极性分子;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体;
故答案为: ;非极性;原子;
;非极性;原子;
(3)若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于O元素,非金属性越强第一电离能越大,故第一电离能N>O>Si>Li,
故答案为:N>O>Si>Li;
(4)以顶点Ti原子进行研究,该晶体中每个钛原子周围与它最近且距离相等的钙离子位于面心,每个顶点为8个晶胞共用,故与Ti原子最近且距离相等的钙离子有8个,晶胞中Ca原子数目=1、Ti原子数目=8×$\frac{1}{8}$=1、O原子数目=12×$\frac{1}{3}$=4,该晶体的化学式为 CaTiO3,
故答案为:8;CaTiO3.
点评 本题考查结构性质位置关系、核外电子排布、分子结构与性质、杂化轨道、电离能、晶胞计算等,难度中等,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 三种溶液中c(Cl-)的关系是①=②=③ | |
| B. | 若将三种溶液稀释相同的倍数,pH变化最小的是② | |
| C. | 三种溶液中由水电离出的c(H+)的关系是①<②<③ | |
| D. | 若向三种溶液中分别加入20mL0.1mol•L-1的NaOH溶液后,pH最小的是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装中的干燥剂必须用特别包装纸包装,其成分多为氧化钙颗粒,也有硅胶颗粒 | |
| B. | 蛋白质、塑料、合成橡胶、光导纤维都是高分子化合物 | |
| C. | Fe2O3、CuO、PbO等金属氧化物是我国古代就已经使用的用于烧碱釉陶的彩色釉面原料 | |
| D. | 控制汽车尾气、工业尾气、建筑扬尘、垃圾焚烧等的任意排放是治理雾霾天气重要环节 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 5:2 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
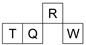 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com