
【题目】“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的副作用.下面化学反应不符合绿色化学理念的是( )
A.消除硫酸厂尾气排放:SO2+2NH3+H2O═(NH4)2SO3
B.治理汽车尾气中NO和CO,可利用催化装置将NO与CO转化成CO2和N2
C.制Cu(NO3)2:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
D.制CuSO4:2Cu+O2 ![]() 2CuO CuO+H2SO4═CuSO4+H2O
2CuO CuO+H2SO4═CuSO4+H2O
科目:高中化学 来源: 题型:
【题目】在常温常压下,已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH1
4Al(s)+3O2(g)=2Al2O3(s) ΔH2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是
A. ΔH3=1/2(ΔH1+ΔH2) B. ΔH3=ΔH2-ΔH1
C. ΔH3=2(ΔH2+ΔH1) D. ΔH3=1/2 (ΔH2-ΔH1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组通过下图所示实验,探究Na2O2与水的反应:
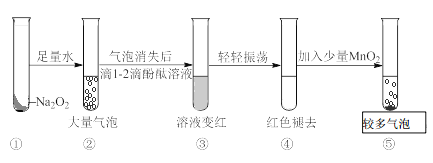
下列说法正确的是
A. ②中的大量气泡主要成分是氢气
B. ③中溶液变红,说明有酸性物质生成
C. ④中现象可能是由于溶液中含有强氧化性物质造成的
D. ⑤中MnO2的主要作用是降低了水中氧气的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法错误的是( )
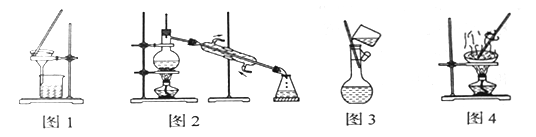
A. 图1所示为除去少量泥水中泥沙的方法
B. 图2所示为制取蒸馏水的方法
C. 图3所示为稀释浓硫酸的方法
D. 图4所示为蒸发氯化钠溶液制氯化钠晶体的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件已略去)。下列推断错误的是
![]()
A. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
B. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
C. 若D是一种强碱,则A.B.C均可与X反应生成D
D. 若D是一种强酸,则A 既可是单质也可是化合物,且D 可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】代沟是化学老师说什么你都不听,代价就是这道题你什么都不会!
I. A、B、C、D四种物质均含有同一种元素。A是常见的金属单质,C的水溶液呈黄色。A、B、C、D之间在一定条件下有如图所示转化关系:
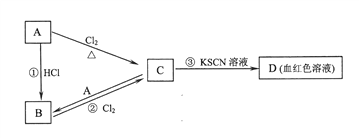
请回答下列问题:
(1)A的化学式是_____________________。
(2)反应①的反应类型为_____________反应(选填“化合”、“分解”、“置换”、“复分解”)。
(3)反应②的化学方程式是___________________________。
(4)C的水溶液与NaOH溶液混合后发生反应的离子方程式是______________________。
II. 实验室可以用如图所示装置制取乙酸乙酯。请回答下列问题:
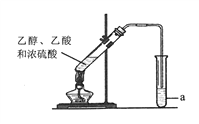
(1)a试管中盛放的是饱和碳酸钠溶液,制得的乙酸乙酯在饱和碳酸钠溶液的________(填“上”或“下”)层。
(2)制取乙酸乙酯的化学方程式是________________,该反应属于_______________反应(填反应类型)。左边试管中在加热前往往加入 ____________以用于防爆沸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物在生产生活中应用比较广泛。
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
①ZnFe2O4中Fe的化合价是___________。
②工业上利用反应ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O 制备ZnFe2O4该反应中还原产物是___(填化学式),每生成1mol ZnFe2O4转移的电子总数是__________。
ZnFe2O4+2CO2↑+4CO↑+6H2O 制备ZnFe2O4该反应中还原产物是___(填化学式),每生成1mol ZnFe2O4转移的电子总数是__________。
(2)工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
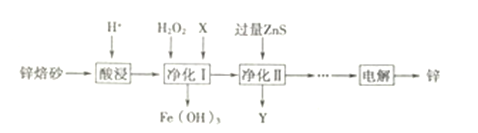
①酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是_______(任答一条)。写出ZnFe2O4溶于酸的离子方程式__________。
②净化I中H2O2 参与反应的离子方程式为___________
③净化Ⅱ中Y 的主要成分是_____(填化学式)。
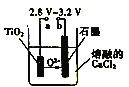
(3)利用锌锰电池在800~1000℃时电解TiO2可制得金属钛,装置如图所示。图中a电极的材料为_____,阴极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com