
����Ŀ������ͭ�����������ֳ����Ľ������ϣ�ijͬѧ�������ϵ�֪����Ҫ��������ʯ���Ȼ�ԭ�ķ���ұ���ģ�����������ʯ�д���������������Ҫ�ɷ�ΪFeS2���ȣ�
��1�����������Ҫ�ɷ�Ϊ���ѧʽ������ҵ���ó�����ұ�����Ļ�ѧ��Ӧ����ʽΪ��
��2���ӿ������ϲ�ã�һ����������Ȼ��������·�Ӧ�� 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4��
�÷�Ӧ�������������ѧʽ��������5molFeS2������Ӧʱ������ת����Ϊ��
��3��ӡˢ��·�����ɸ߷��Ӳ��Ϻ�ͭ�����϶��ɣ�����ӡˢ��·ʱ����FeCl3��Һ������ʴҺ������д�����ƹ��̵����ӷ���ʽ ��
���𰸡�
��1��Fe2O3��Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
��2��CuSO4��FeS2��21NA
��3��Cu+2Fe3+=2Fe2++Cu2+
���������⣺��1�����������Ҫ�ɷ�Ϊ����������ѧʽΪFe2O3 �� ��ҵ����һ����̼��ԭ������ұ������ͬʱ���ɶ�����̼����Ӧ�Ļ�ѧ����ʽΪFe2O3+3CO ![]() 2Fe+3CO2 �� ���Դ��ǣ�Fe2O3��Fe2O3+3CO
2Fe+3CO2 �� ���Դ��ǣ�Fe2O3��Fe2O3+3CO ![]() 2Fe+3CO2 ����2���ڷ�Ӧ14CuSO4+5FeS2+12H2O�T7Cu2S+5FeSO4+12H2SO4�У�ͭ��+2�۽�Ϊ+1�ۣ���ө�1�۽�Ϊ��2�ۣ����Է�Ӧ��������ΪCuSO4��FeS2 �� ��Ӧ�л��ϼ۽��͵�����Ϊ14��1+7��1=21��������5molFeS2������Ӧʱ������ת�Ƶ����ʵ���Ϊ21mol����ĿΪ21NA ��
2Fe+3CO2 ����2���ڷ�Ӧ14CuSO4+5FeS2+12H2O�T7Cu2S+5FeSO4+12H2SO4�У�ͭ��+2�۽�Ϊ+1�ۣ���ө�1�۽�Ϊ��2�ۣ����Է�Ӧ��������ΪCuSO4��FeS2 �� ��Ӧ�л��ϼ۽��͵�����Ϊ14��1+7��1=21��������5molFeS2������Ӧʱ������ת�Ƶ����ʵ���Ϊ21mol����ĿΪ21NA ��
���Դ��ǣ�CuSO4��FeS2��21NA����3������ӡˢ��·ʱ����FeCl3��Һ��ͭ��Ӧ�����������Ӻ�ͭ���ӣ���Ӧ�����ӷ���ΪCu+2Fe3+=2Fe2++Cu2+ ��
���Դ��ǣ�Cu+2Fe3+=2Fe2++Cu2+ ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����������̿�MnO2������Al2O3������п��ZnS������FeS����������Zn��MnO2 �� �䲿�������������£� 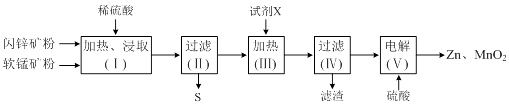
��֪�����ˣ���������Һ��MnSO4��ZnSO4��Fe2��SO4��3��Al2��SO4��3�Ļ��Һ����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩���±���
������ | Fe��OH��3 | Al��OH��3 | Zn��OH��2 | Mn��OH��2 |
��ʼ����ʱ��pH | 2.7 | 4.0 | 6.4 | 7.7 |
��ȫ����ʱ��pH | 3.7 | 5.2 | 8.0 | 10.4 |
��1�����ȡ���ȡʱ���ӿ�ʯ������飬��Ŀ���� ��
��2��д��FeS��MnO2��ϡ���ᷴӦ�����ӷ���ʽ�� ��
��3���Լ�X�������ǵ�����Һ��pH������Fe��OH��3��Al��OH��3 �� pH���ڵķ�Χ�� �� �Լ�X����ѡ������ѡ����ĸ����
A��MnCO3 B��Na2CO3 C��Zn2��OH��2CO3 D��NH3H2O
��4����⣨�����������ĵ缫��ӦʽΪ ��
��5��Zn��MnO2��������ص�ԭ�ϣ�ijп���̼��Ե����KOH��ҺΪ�������Һ�������ܷ�ӦʽΪ��Zn��s��+2MnO2��s��+H2O��l��=Zn��OH��2��s��+Mn2O3��s�����õ�ص������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫȼ��ij��1.06g�����ɱ�״����1.792LCO2��0.9gˮ����������������������ܶ�Ϊ53�Ҹ�����ʹ���Ը��������Һ��ɫ��������ʹ������Ȼ�̼��Һ��ɫ��д�������ķ���ʽ�Լ����ܵĽṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2CO3��NaHCO3�����ֳ��������Σ�
��1���ýྻ�IJ�˿պȡNa2CO3��Һ���ھƾ��ƻ��������գ������ɫ��
��2����������Na2CO3��NaHCO3�ֱ������������ᷴӦ������ͬ�����²���CO2�����V��Na2CO3�� V��NaHCO3������ڡ�����С�ڡ����ڡ���
��3��������10.00g��̼���ƺ�̼�����ƵĻ���ʹ̼��������ȫ�ֽ⣬��������������� 2.48g����ԭ�������̼���Ƶ���������Ϊ ��
��4����ʵ��������2mol/L��Na2CO3��Һ950mL������ʱӦѡ������ƿ�Ĺ��ͳ�ȡNa2CO3�������ֱ��� ��
A�� 1000ml�� 212g B��950ml��543.4g C�������� 572g D��500ml�� 106g
����Ҫ�IJ�������������ƿ�����������ձ�����Ͳ����ȱ�ٵIJ�������������д����
�����ƣ�������������������н�����������ҺŨ��ƫ�ߵ����������б�ţ���
A������ƿʵ��ǰ������ˮϴ�ɾ�����δ���
B�����ݹ۲�Һ��ʱ����
C��δ��ȴ�����¾Ϳ�ʼ����
D��������ˮʱ���������˿̶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na3N�ǿ�ѧ���Ʊ����»���������Ժ�ˮ��Ӧ�������ּ������ʣ�����һ��A���Է�������ת����ϵ����A��B��C��DΪ��ѧ���������Ҿ�����ͬһ��Ԫ�أ���Ӧ���������������Ѿ���ȥ���� A ![]() B
B ![]() C
C ![]() D
D
��1��Na3N��N�Ļ��ϼ�Ϊ��
��2��д��Na3N��ˮ��Ӧ�Ļ�ѧ����ʽ����
��3��д��C��D�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����ﲻ���ɵ���֮��ֱ�ӻ��ϵõ�����(����)
A. FeS B. H2S C. SO3 D. FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����̼ԭ�Ӻ���ԭ�Ӹ�����Ϊ3��4����������ˮ��Ӧȴ��ʹ����KMnO4��Һ��ɫ���������ܶ�����ͬ״���¼����ܶȵ�7.5������������ʱ���巴Ӧ������������һ�������л�������ǣ� ��
A.CH��C��CH3
B.![]()
C.CH2�TCHCH3
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ��ͼ��ʾ�������л�ѧ��Ӧ����3 ������ǣ� �� 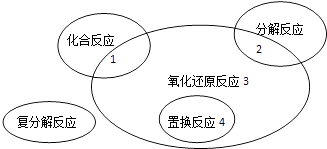
A.Cl2+2KBr�TBr2+2KCl
B.2NaHCO3�TNa2CO3+H2O+CO2��
C.4Fe��OH��2+O2+2H2O ![]() 4Fe��OH��3
4Fe��OH��3
D.2Na2O2+2CO2�T2Na2CO3+O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ�ѧʽд��P������ʵ�����ΪP4����������������ʵ����������������ʽ���ڵģ���֪P4O6������ֻ���е�������ÿ��ԭ�ӵ�����㶼����8���ӽṹ��������к��еĹ��ۼ�����Ŀ�ǣ� ��
A.10B.12C.24D.28
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com