(1)在下列三种溶液中①10ml0.2mol/LCH3COOH;②10ml0.1mol/LH2SO4;③20ml0.1mol/LHCl;其中C(H+)最大的是(一律用序号)______; C(H+)最小的是______;
(2)常温下,浓度为1×10-5mol/l的NaOH溶液中,由水电离产生的C(OH-)=______;
(3)将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合后,溶液的pH=______.
【答案】
分析:(1)①10ml0.2mol/LCH
3COOH,CH
3COOH是弱电解质,电离程度不大,溶液中c(H
+)远小于0.1mol/L;
②10ml0.1mol/LH
2SO
4,H
2SO
4是强电解质,完全电离,溶液中c(H
+)=0.2mol/L;
③20ml0.1mol/LHCl,HCl是强电解质,完全电离,溶液中c(H
+)=0.1mol/L;
(2)浓度为1×10
-5mol/L的NaOH溶液中c(OH
-)=1×10
-5mol/L,溶液中氢离子是水电离产生的,根据Kw=c(H
+)?c(OH
-)计算溶液中c(H
+),水电离的氢离子浓度与水电离的氢氧根浓度相等,据此计算水电离的氢氧根浓度;
(3)将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合,氢氧化钡有剩余,溶液呈碱性,混合后溶液中c(OH
-)=0.01mol/L,根据Kw=c(H
+)?c(OH
-)计算溶液中c(H
+),再根据PH=-lgc(H
+)计算.
解答:解:(1)①10ml0.2mol/LCH
3COOH,CH
3COOH是弱电解质,电离程度不大,溶液中c(H
+)远小于0.1mol/L;
②10ml0.1mol/LH
2SO
4,H
2SO
4是强电解质,完全电离,溶液中c(H
+)=0.2mol/L;
③20ml0.1mol/LHCl,HCl是强电解质,完全电离,溶液中c(H
+)=0.1mol/L,
故c(H
+)最大的是②;c(H
+)最小的是①,故答案为:②;①;
(2)浓度为1×10
-5mol/L的NaOH溶液中c(OH
-)=1×10
-5mol/L,溶液中氢离子是水电离产生的,溶液中c(H
+)=
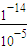
mol/L=1×10
-9mol/L,水电离的氢离子浓度与水电离的氢氧根浓度相等,水电离的氢氧根浓度为1×10
-9mol/L,
故答案为:1×10
-9mol/L;
(3)氢氧化钠溶液中c(OH
-)=0.06mol/L×2=0.12mol/L,将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合,氢氧化钡有剩余,溶液呈碱性,混合后溶液中c(OH
-)=
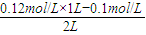
=0.01mol/L,剩余溶液中c(H
+)=
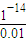
mol/L=1×10
-12mol/L,故溶液pH=-lgc(H
+)=-lg(1×10
-12)=12,
故答案为:12.
点评:本题考查强弱电解质的电离、水的离子积的有关计算、溶液PH值的计算等,难度中等,(3)中注意,计算溶液的pH值,首先判断溶液的酸碱性,若为酸性,则计算溶液中氢离子浓度,再利用PH定义计算;若为碱性,先计算氢氧根离子的浓度,再利用水的离子积计算溶液中氢离子浓度,最后利用pH定义计算.

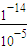 mol/L=1×10-9mol/L,水电离的氢离子浓度与水电离的氢氧根浓度相等,水电离的氢氧根浓度为1×10-9mol/L,
mol/L=1×10-9mol/L,水电离的氢离子浓度与水电离的氢氧根浓度相等,水电离的氢氧根浓度为1×10-9mol/L,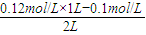 =0.01mol/L,剩余溶液中c(H+)=
=0.01mol/L,剩余溶液中c(H+)=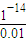 mol/L=1×10-12mol/L,故溶液pH=-lgc(H+)=-lg(1×10-12)=12,
mol/L=1×10-12mol/L,故溶液pH=-lgc(H+)=-lg(1×10-12)=12,
