
����Ŀ��25 �棬������ĵ���ƽ�ⳣ�����±�������������ȷ����(����)
Ka1 | Ka2 | |
H2A | 1.3��10-2 | 6.3��10-6 |
H2B | 4.2��10-7 | 5.6��10-11 |
A. H2A�ĵ��뷽��ʽ��H2A 2H����A2-
B. �����£���ˮ��Na2B��ˮ��ƽ�ⳣ��Ϊ��![]()
C. ��ͬpH��Na2A��Na2B��Һ�����ʵ���Ũ�ȣ�c(Na2A)��c(Na2B)
D. ��Na2B��Һ�м�������H2A��Һ���ɷ�����Ӧ��B2����H2AA2����H2B
���𰸡�C
��������
A�����ݵ���ƽ�ⳣ��H2A��H2B����������ʣ����߷ֲ����룬���Ե�һ������Ϊ��������H2AH++HA-����A����B��ˮ�ⷽ��ʽΪB2-+H2OHB-+OH-��Kh1=![]() �����Ӻͷ�ĸͬ���������ӵ�Ũ�ȣ���Kh1=
�����Ӻͷ�ĸͬ���������ӵ�Ũ�ȣ���Kh1=![]() ����B����C�����������Ӧ����Խ��Խˮ�⣬����Խǿ���������ԣ�HA-��HB-��������ͬŨ�ȵ�Na2A��Na2B��pH��Na2B�Ĵ�����ͬpH��Na2A��Na2B��Һ�����ʵ���Ũ�ȣ�c(Na2A)��c(Na2B)����C��ȷ��D����Ϊ����H2A��HA-��H2B������2B2-+H2A�TA2-+2HB-�����ܷ�Ӧ����H2B����D����ѡC��
����B����C�����������Ӧ����Խ��Խˮ�⣬����Խǿ���������ԣ�HA-��HB-��������ͬŨ�ȵ�Na2A��Na2B��pH��Na2B�Ĵ�����ͬpH��Na2A��Na2B��Һ�����ʵ���Ũ�ȣ�c(Na2A)��c(Na2B)����C��ȷ��D����Ϊ����H2A��HA-��H2B������2B2-+H2A�TA2-+2HB-�����ܷ�Ӧ����H2B����D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ø�����غ�Ũ������ȡ��������Ӧ����ʽ���£�
[___]KMnO4+[___]HCl��Ũ����[___]KCl+[___]MnCl2+[___]Cl2+[___]H2O
��1����ƽ������Ӧ�Ļ�ѧ����ʽ�����õ����ű������ת�Ʒ������Ŀ��__________
��2����Ӧ�У�HCl ���ֵĻ�ѧ����Ϊ____��
��3������Ӧ���� 2molHCl��ת�Ƶ�����ĿΪ_____����
��4����SO2����ͨ��KMnO4��Һ�У���Һ��ɫ������Mn2+��д��������Ӧ�����ӷ���ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶�ʱ����һ��10L�ĺ��������У�X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ�
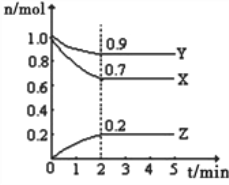
��1����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ______________________��
��2��ƽ��ʱ�����ڻ�������ܶȱ���ʼʱ__________����������С������ȡ���ͬ������������ƽ����Է�����������ʼʱ___________��
��3����a mol X��b mol Y�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n��X��=n��Y��=2n��Z������ԭ���������a��b=___________��
���ں��º��ݵ��ܱ������У����������������ٷ����仯ʱ���ٻ�������ѹǿ���ڻ��������ܶȣ��ۻ������������ʵ������ܻ�������ƽ����Է����������ݻ���������ɫ������Ӧ���������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȡ�
��1��һ����֤��2SO2(g)��O2(g)![]() 2SO3(g)�ﵽƽ��״̬����_______������ţ�
2SO3(g)�ﵽƽ��״̬����_______������ţ�
��2��һ����֤��I2(g)��H2(g)![]() 2HI(g)�ﵽƽ��״̬���� _________��������ţ�
2HI(g)�ﵽƽ��״̬���� _________��������ţ�
��3��һ����֤��A(s)��2B(g)![]() C(g)��D(g)�ﵽƽ��״̬����________����ע��B,C,D��Ϊ��ɫ���ʣ�
C(g)��D(g)�ﵽƽ��״̬����________����ע��B,C,D��Ϊ��ɫ���ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ�RMgX��Mg��±����RX�ڸ����µ������з�Ӧ�Ƶã��㷺���ڸ����л���ĺϡ���ͼ���������ϣ�![]() ���ĺϳ�·�ߡ�
���ĺϳ�·�ߡ�

��1��д����Ӧ��ķ�Ӧ����____����Ӧ��ķ�Ӧ����Ϊ____��������C��������____��
��2��д���������ʵĽṹ��ʽ: E____ , F____��
��3��д���� �� C�Ļ�ѧ����ʽ��____
��4��A�ж���ͬ���칹�壬���б����������ֻ�ѧ�������ͬ���칹�壨��-MgBr�ṹ����____�֡�
��5�����ԭ�ϣ�![]() ���ϳɲ��
���ϳɲ�� ���ĺϳ�·�ߣ�____
���ĺϳ�·�ߣ�____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1������>������<��������
�ǽ����� | �۵� | �е㣨ͬѹ�� | ���� |
P___S | MgO ___CaS | CF4 ___SiCl4 | H-Cl___H-Br |
��2��һ����ȡNH2OH�ķ�ӦΪ2NO2-+4SO2+6H2O+6NH3=4S042-+6NH4++2NH2OH��
��N��H��O�ĵ縺�Դ�С�����˳��Ϊ____��
��NH2OH��Nԭ�ӵ��ӻ�����Ϊ____��
��NHOH��������H2O������Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ____��
��3�������K[PtCl3��NH3��]��[PtCl3��NH3��]-�Ľṹ����ʾ��ͼ��ʾΪ_____�������ǿռ乹�ͣ���1molK[PtCl3��NH3��]�к�����������ĿΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ������Һ���Ƿ��г���������������,��������ͼ��ʾ��ʵ����������м�������в�����������ʹʪ��ĺ�ɫʯ����ֽ�������ɸ�ʵ���ܵõ�����ȷ�����ǣ� ��
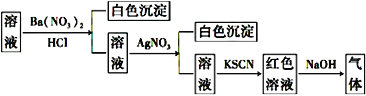
A. ԭ��Һ��һ������SO42-B. ԭ��Һ��һ������NH4+
C. ԭ��Һ��һ������Cl-D. ԭ��Һ��һ������Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)Na2CO3�׳ƴ��д��ˮ�ⳣ���ı���ʽΪKh=___________����֪25��ʱ��Kh=2��10-4mol/L������Һ��c(HCO3-)��c(CO32-) = 2��1ʱ��������Һ��pH=____��
(2)������Ũ��Ϊ0.1 mol��L-1�����ᡢ���ᡢ����������Һ��
��������Һ��Ũ������Ϊa mol��L-1��b mol��L-1��c mol��L-1�����С˳��Ϊ____________��
�ڵ������������ֱ���NaOH��Һ�к���������ʱ������NaOH�����ʵ���������n1��n2��n3�����С��ϵ_______________��
(3)��AlCl3��Һ���ɡ����գ����õ�����Ҫ���������___________________��
(4)�ڴ�����Һ�е����̪����Һ���ɫ�����ڸ���Һ���ٵ��������BaCl2��Һ�����۲쵽��������_____________��ԭ����______________�������������ӷ���ʽ�����ּ��Խ��ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC��s����H2O��g��![]() CO��g����H2��g����һ����ɱ�������н��С����������ĸı���仯ѧ��Ӧ���ʼ���û��Ӱ����ǣ�������C���������ڽ����������Сһ�룻�۱�������������䣬���뵪��ʹ������ѹǿ���ܱ���ѹǿ���䣬���뵪��ʹ������������
CO��g����H2��g����һ����ɱ�������н��С����������ĸı���仯ѧ��Ӧ���ʼ���û��Ӱ����ǣ�������C���������ڽ����������Сһ�룻�۱�������������䣬���뵪��ʹ������ѹǿ���ܱ���ѹǿ���䣬���뵪��ʹ������������
A. �ڢ� B. �٢� C. �ۢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10mL0.40mol/L H2O2�������ֽ⡣��ͬʱ�̲ⶨ����O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A��0~6min��ƽ����Ӧ���ʣ�v��H2O2��![]()
![]() mol/(L��min)
mol/(L��min)
B��6~10min��ƽ����Ӧ���ʣ�v��H2O2����![]() mol/(L��min)
mol/(L��min)
C����Ӧ��6minʱ��c��H2O2��=0.3mol/L
D����Ӧ��6minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com