
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
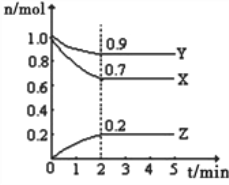
(1)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(2)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号)
2SO3(g)达到平衡状态的是_______(填序号)
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。(填序号)
2HI(g)达到平衡状态的是 _________。(填序号)
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
【答案】0.01mol/(L·min)相等变大7:5①③④⑤②④
【解析】
I.(1)v(Z)=0.2/(2×10)mol/(L·min)=0.01 mol/(L·min),故答案为:0.01 mol/(L·min);
(2)组分都是气体,容积不变,因此反应前后气体密度不变,根据M=m/n,组分都是气体,气体质量不变,向正反应方向进行,气体物质的量减小,则M增大;故答案为:相等、变大;
(3)设转化的X为3x,由三段式分析如下:
3X + Y![]() 2Z
2Z
起始: a b 0
变化: 3x x 2x
某时刻:a-3x b-x 2x
n(X)=n(Y)=2n(Z),因此有a-3x=b-x,a-3x=4x,a=7x,b=5x,因此a:b=7x:5x=7:5;故答案为:7:5;
II.(1)①反应前后气体系数之和不相等,因此压强不变,说明反应达到平衡,故①正确;②组分都是气体,气体质量不变,是恒容状态,容器的体积不变,因此密度不变,不能说明反应达到平衡,故②错误;③向正反应方向进行,气体物质的量减少,因此总物质的量不变,说明反应达到平衡,故③正确; ④根据M=m/n,组分都是气体,气体质量不变,向正反应方向进行,气体物质的量减小,因此当M不变,说明反应达到平衡,故④正确;⑤组分都是无色气体,因此颜色不变,不能说明反应达到平衡,故⑤错误;⑥没有指明反应进行方向,故⑥错误;故答案为:①③④;
(2)①反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故①错误;②组分都是气体,气体质量不变,是恒容状态,容器的体积不变,因此密度不变,不能说明反应达到平衡,故②错误;③反应前后气体系数之和相等,因此物质的量不变,不能说明反应达到平衡,故③错误; ④根据M=m/n,组分都是气体,气体质量不变,气体总物质的量不变,因此当M不变,不能说明反应达到平衡,故④错误;⑤I2是有颜色的气体,因此颜色不变,说明反应达到平衡,故⑤正确;⑥没有指明反应进行方向,故⑥错误;故答案为:⑤;
(3)①反应前后气体系数之和相等,因此压强不变,不能说明反应达到平衡,故①错误;②A为固体,其余为组分都是气体,气体质量增加,是恒容状态,容器的体积不变,因此密度不变,说明反应达到平衡,故②正确;③气体物质的量不变,因此总物质的量不变,不能说明反应达到平衡,故③错误; ④根据M=m/n,气体质量增加,气体物质的量不变,因此当M不变,说明反应达到平衡,故④正确;⑤题目中没有说明气体的颜色,因此颜色不变,不能说明反应达到平衡,故⑤错误;⑥没有指明反应进行方向,故⑥错误,故答案为:②④;


科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是

A. 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C. 在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·![]()
![]()
D. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“未来金属”钛的信息有:①硬度大②熔点高③常温下耐酸碱、耐腐蚀,由钛铁矿钛的一种工业流程为:

(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价___价,反应①化学方程式为___。
(2)反应②的化学方程式为TiO2+C+Cl![]() TiCl4+CO(未配平),该反应中每消耗12gC,理论上可制备TiCl4___g。
TiCl4+CO(未配平),该反应中每消耗12gC,理论上可制备TiCl4___g。
(3)TiCl4在高温下与足量Mg反应生成金属Ti,反应③化学方程式___,该反应属于___(填基本反应类型)
(4)上述冶炼方法得到的金属钛中会混有少量金属单质是___(填名称),由前面提供的信息可知,除去它的试剂可以是以下剂中的___(填序号)
A HCl BNaOH CNaCl DH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)煅烧成生石灰;②在引有海水的渠中加入生石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解获得产物。根据上述提取镁的全过程,没有涉及的反应类型是( )
A.分解反应B.化合反应
C.置换反应D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大第三周期元素。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素氢化物中有2个氢原子,试回答:
(1)写出B原子结构示意图___
(2)元素最高价氧化物对应水化物中碱性最强的是___,写出一种含有F元素的具有漂白性的物质___(用化学式表示)。
(3)用电子式表示A、F原子形成化合物的过程___。
(4)C、F两种元素最高价氧化物的水化物之间反应的离子方程式___。
(5)设计实验证明E、F两种元素非金属性的强弱___(化学方程式加必要文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与稀硫酸反应的离子方程式书写正确的是
A. 2Fe + 6H+ = 2Fe3+ + 3H2↑
B. Fe + 2H+ = Fe2+ + H2↑
C. Fe + 2H+ + SO42- = FeSO4↓+ H2↑
D. 2Fe + 6H+ + 3SO42- = Fe2(SO4)3↓+ 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯是无色、无味的液体
B.苯易溶于水,有毒性
C.苯可以使高锰酸钾酸性溶液褪色
D.在催化剂作用下,苯可以与液溴发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离平衡常数如下表,下列叙述正确的是( )
Ka1 | Ka2 | |
H2A | 1.3×10-2 | 6.3×10-6 |
H2B | 4.2×10-7 | 5.6×10-11 |
A. H2A的电离方程式:H2A 2H++A2-
B. 常温下,在水中Na2B的水解平衡常数为:![]()
C. 相同pH的Na2A、Na2B溶液中物质的量浓度:c(Na2A)>c(Na2B)
D. 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2AA2-+H2B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol H2含有的分子数目为2NA
B. 0.5 mol H2SO4所含的原子总数目为0.5NA
C. 1 mol O3含有的氧原子数为2NA
D. 0.5 mol H2O含有NA个氢原子和0.5NA个氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com