
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol H2含有的分子数目为2NA
B. 0.5 mol H2SO4所含的原子总数目为0.5NA
C. 1 mol O3含有的氧原子数为2NA
D. 0.5 mol H2O含有NA个氢原子和0.5NA个氧原子
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
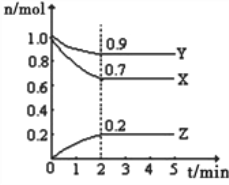
(1)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(2)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号)
2SO3(g)达到平衡状态的是_______(填序号)
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。(填序号)
2HI(g)达到平衡状态的是 _________。(填序号)
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是________。(注:B,C,D均为无色物质)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2CO3俗称纯碱,写出水解常数的表达式为Kh=___________。已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-)∶c(CO32-) = 2∶1时,试求溶液的pH=____。
(2)氢离子浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,
①三种溶液的浓度依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为____________。
②等体积的三种酸分别与NaOH溶液中和生成正盐时,消耗NaOH的物质的量依次是n1、n2、n3,其大小关系_______________。
(3)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。
(4)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_____________;原因是______________。(结合相关离子方程式和文字加以解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z的原子序数之和为22,且Y2-与Z3+核外电子排布相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.X2Y2B.X2YC.Z2Y3D.X3ZY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为_______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)已知50 ℃时c(MnO4—)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4—)~t的变化曲线示意图_____。

(4)在25 ℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.0kJ,则表示甲烷燃烧热的热化学方程式是____________________________。
(5)已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示。该反应是一个______________(填“熵增”或“熵减”)的反应。下列有关该反应的叙述中正确的是______。

A.该反应是放热反应
B.该反应的ΔH=-(E1-E2) kJ· mol-1
C.该反应中反应物的键能总和大于生成物的键能总和
D.由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液溶质的质量分数为10%,下面说法正确的是( )
①在100份质量溶液中含有10份质量溶质;②在110份质量溶液中含有10份质量溶质;
③在100份质量溶剂中含有10份质量溶质;④在90份质量溶剂中溶有10份质量溶质。
A. ①② B. ③④ C. ②③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com