
【题目】短周期元素X、Y、Z的原子序数之和为22,且Y2-与Z3+核外电子排布相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.X2Y2B.X2YC.Z2Y3D.X3ZY3
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大第三周期元素。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素氢化物中有2个氢原子,试回答:
(1)写出B原子结构示意图___
(2)元素最高价氧化物对应水化物中碱性最强的是___,写出一种含有F元素的具有漂白性的物质___(用化学式表示)。
(3)用电子式表示A、F原子形成化合物的过程___。
(4)C、F两种元素最高价氧化物的水化物之间反应的离子方程式___。
(5)设计实验证明E、F两种元素非金属性的强弱___(化学方程式加必要文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是
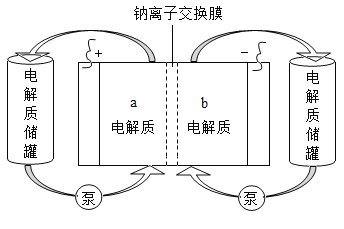
A. 放电时,负极反应为3NaBr - 2e-=== NaBr3 + 2Na+
B. 充电时,阳极反应为2Na2S2 - 2e -=== Na2S4 + 2Na+
C. 放电时,Na+经过离子交换膜,由a池移向b池
D. 用该电池电解饱和食盐水,产生0.1molH2时,b池生成17.40 gNa2S4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________。试写出NaHCO3溶液显碱性的的离子方程式________,
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______________。
(3)体积相同、pH相同的CH3COOH溶液和HClO溶液,与NaOH溶液中和时两者消耗NaOH的物质的量________(填字母)。
A.相同 B.中和CH3COOH的多
C.中和HClO的多 D.无法比较
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水 稀释至1 000 mL,稀释过程pH变化如图所示,则HX的电离常数 ________(填“大于”“等于”或“小于”)醋酸的电离常数。

(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______ (填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A ⑤A中有锌剩余 ⑥B中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷中混有乙烯,欲除去乙烯得到纯净的乙烷气体,最好依次通过哪一组试剂
A. 澄清石灰水、浓硫酸
B. 酸性高锰酸钾溶液、浓硫酸
C. 溴水、浓硫酸
D. 足量氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol H2含有的分子数目为2NA
B. 0.5 mol H2SO4所含的原子总数目为0.5NA
C. 1 mol O3含有的氧原子数为2NA
D. 0.5 mol H2O含有NA个氢原子和0.5NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示,试回答下列问题。

(1)图中①、②、③、④装置可盛放的试剂是
①________;②________;③________;④________。(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是_____________。
(3)使用装置②的目的是___________。使用装置③的目的是____________。
(4)能说明含有乙烯的现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,C(s)+CO2(g)![]() 2CO (g) ΔH>0。下列有关叙述正确的是
2CO (g) ΔH>0。下列有关叙述正确的是
A. 升高温度,v(正)增大,v(逆)减小
B. 增大压强,v(正)增大,v(逆)增大
C. 恒温恒压,再充入N2,反应速率不变
D. 增加炭的用量,v(正)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。

Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
(1)写出该反应的离子方程式 ___________________________________________________;为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是______________;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________________。
(3)试简述测定该反应的化学反应速率的其他方法:_______________________________________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究大理石规格(粗、细)对该反应速率的影响。 |
② | _______ | 粗颗粒 | ______ | |
③ | ____ | ___ | 2.00 | |
④ | 298 | ________ | _____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com