
【题目】乙烷中混有乙烯,欲除去乙烯得到纯净的乙烷气体,最好依次通过哪一组试剂
A. 澄清石灰水、浓硫酸
B. 酸性高锰酸钾溶液、浓硫酸
C. 溴水、浓硫酸
D. 足量氢气
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)某原子含有6个质子和8个中子,用核素符号表示该原子___(用元素符号表示)。
(2)写出HClO的电子式___,CS2的结构式___。
(3)S2﹣、Al3+、Na+、F﹣四种离子半径由大到小顺序为___,H2O、H2S、I2三种分子熔沸点由高到低顺序为___。
(4)Na2O2中含有的化学键类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2 还原出的汞呈气态,冷凝得液态汞。其流程如下图:
Hg+SO2 还原出的汞呈气态,冷凝得液态汞。其流程如下图:
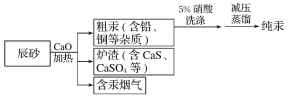
下列说法中,不正确的是
A. HgS+O2![]() Hg+SO2 属于置换反应
Hg+SO2 属于置换反应
B. 含汞烟气必须处理达标后才能排放
C. 流程中加入氧化钙的目的是减少SO2的排放
D. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)保持100℃的恒温,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____________________。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”,“中性”或“碱性”),醋酸体积____________氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,上述离子浓度大小关系中正确的是(选填字母)________。
②若上述关系中D是正确的,则溶液中的溶质为____________________;
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)= _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列物质间的反应,能够说明“反应条件(如温度、浓度、用量等)不同得到产物不同”的观点的是( )
A.金属钠与水B.铁粉与盐酸
C.氢气与氯气D.二氧化碳和澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z的原子序数之和为22,且Y2-与Z3+核外电子排布相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.X2Y2B.X2YC.Z2Y3D.X3ZY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
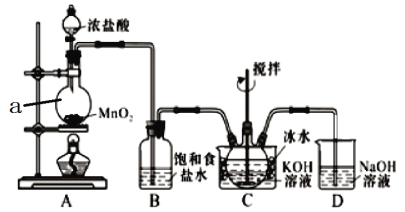
(査阅资料)① Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;② K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是_________;装置A中反应的化学方程式为__________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是_________________________________。
(3)装置B吸收的气体是_________,装置D的作用是___________________________。
(4)C中得到足量KC1O后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为__________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是___________。
(6)若实验中消耗了VmL c mol/L的Fe(NO3)3溶液,Fe(NO3)3充分反应,最终制得a g的K2FeO4固体,则本实验K2FeO4的产率为 ______________(列出算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com