
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是
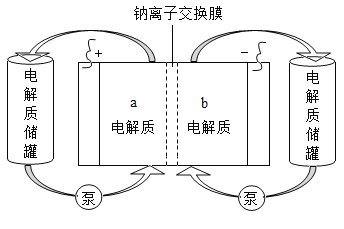
A. 放电时,负极反应为3NaBr - 2e-=== NaBr3 + 2Na+
B. 充电时,阳极反应为2Na2S2 - 2e -=== Na2S4 + 2Na+
C. 放电时,Na+经过离子交换膜,由a池移向b池
D. 用该电池电解饱和食盐水,产生0.1molH2时,b池生成17.40 gNa2S4
【答案】D
【解析】
放电时Na+由b乙池向a池移动,在原电池中, a池为正极,阳离子移向正极,得到电子,发生还原反应,b池为负极,阴离子失去电子,发生氧化反应;充电时与放电相反,a池发生氧化反应,为电解池的阳极,b池发生还原反应,为电解池的阴极,据此分析。
A.放电时,负极反应为2Na2S2-2e-=Na2S4+2Na+,A错误;
B.充电时,阳极反应为3NaBr-2e-=NaBr3+2Na+,B错误;
C.在原电池中,阳离子移向正极,Na+经过离子交换膜,由b池移向a,C错误;
D.该原电池与电解池是串联电路,H+得到电子生成H2与Na2S2失去电子生成Na2S4的电子总数相等,即2H+~H2~2e-~2Na2S2~Na2S4,所以n(Na2S4)=n(H2)=0.1mol,m(Na2S4)=0.1mol×174g/mol=17.40g,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8.若配置该营养液,取214gNH4Cl,则需KCl和K2SO4的质量分别为( )
A.53.5g和214gB.37.25g和348g
C.74.5g和696gD.149g和696g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g) ![]() pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
(1)该反应的逆反应是________反应(填“放热”或“吸热”),且a+b______p(填“<”、“>”或“=”)。
(2)温度、容器体积不变,平衡后加入B,A的转化率_________,B的转化率_________。(填“增大”、“减小”或“不变”)
(3)若升高温度,再次平衡时,B、C的浓度之比将_____________。(填“增大”、“减小”或“不变”)
(4)若加入催化剂,再次平衡时气体混合物的总物质的量___________。(填“增大”、“减小”或“不变”)
(5)若B是有色气体,A、C无色,平衡后压缩容器体积为原来的一半,再次平衡时,容器内气体颜色____。若维持容器内气体压强不变,充入Ne,再次平衡时,容器内气体颜色__________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)用“>”或“<”填写下表。
非金属性 | 熔点 | 沸点(同压) | 键能 |
P___S | MgO ___CaS | CF4 ___SiCl4 | H-Cl___H-Br |
(2)一种制取NH2OH的反应为2NO2-+4SO2+6H2O+6NH3=4S042-+6NH4++2NH2OH。
①N、H、O的电负性从小到大的顺序为____。
②NH2OH中N原子的杂化类型为____。
③NHOH极易溶于H2O,除因为它们都是极性分子外,还因为____。
(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为_____(不考虑空间构型),1molK[PtCl3(NH3)]中含有σ键的数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2 还原出的汞呈气态,冷凝得液态汞。其流程如下图:
Hg+SO2 还原出的汞呈气态,冷凝得液态汞。其流程如下图:
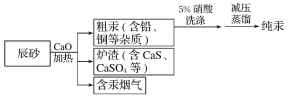
下列说法中,不正确的是
A. HgS+O2![]() Hg+SO2 属于置换反应
Hg+SO2 属于置换反应
B. 含汞烟气必须处理达标后才能排放
C. 流程中加入氧化钙的目的是减少SO2的排放
D. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2CO3俗称纯碱,写出水解常数的表达式为Kh=___________。已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-)∶c(CO32-) = 2∶1时,试求溶液的pH=____。
(2)氢离子浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,
①三种溶液的浓度依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为____________。
②等体积的三种酸分别与NaOH溶液中和生成正盐时,消耗NaOH的物质的量依次是n1、n2、n3,其大小关系_______________。
(3)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。
(4)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_____________;原因是______________。(结合相关离子方程式和文字加以解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)保持100℃的恒温,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____________________。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”,“中性”或“碱性”),醋酸体积____________氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,上述离子浓度大小关系中正确的是(选填字母)________。
②若上述关系中D是正确的,则溶液中的溶质为____________________;
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)= _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z的原子序数之和为22,且Y2-与Z3+核外电子排布相同。下列化合物中同时存在极性共价键和非极性共价键的是( )
A.X2Y2B.X2YC.Z2Y3D.X3ZY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的电化学脱硫是借助煤在电解槽阳极发生的电化学氧化反应,将煤中黄铁矿(FeS2)或有机硫化物氧化成可溶于水的含硫化合物而达到净煤目的,下图是一种脱硫机理,则下列说法正确的是
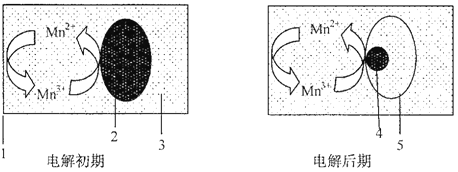
l—电极a 2—黄铁矿 3—MnSO4、H2SO4混合溶液 4—未反应黄铁矿 5一电解产品
A. Mn3+充当了电解脱硫过程的催化剂
B. 电极a应与电源负极相连
C. 脱硫过程中存在的离子反应为:8H2O+FeS2+15Mn3+=Fe3++16H++2SO42-+15Mn2+
D. 阴极发生的反应:2H2O+2e-=4H++O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com