
����Ŀ�����з�ӦaA(g)+bB(g) ![]() pC(g)����֪���ﵽƽ��������¶ȣ�B��ת���ʱ��Сѹǿ��C������������С��
pC(g)����֪���ﵽƽ��������¶ȣ�B��ת���ʱ��Сѹǿ��C������������С��
��1���÷�Ӧ���淴Ӧ��________��Ӧ����������������������������a+b______p������<������>������=������
��2���¶ȡ�����������䣬ƽ������B��A��ת����_________��B��ת����_________��������������������С��������������
��3���������¶ȣ��ٴ�ƽ��ʱ��B��C��Ũ��֮�Ƚ�_____________��������������������С��������������
��4��������������ٴ�ƽ��ʱ��������������ʵ���___________��������������������С��������������
��5����B����ɫ���壬A��C��ɫ��ƽ���ѹ���������Ϊԭ����һ�룬�ٴ�ƽ��ʱ��������������ɫ____����ά������������ѹǿ���䣬����Ne���ٴ�ƽ��ʱ��������������ɫ__________��������������������dz��������������
���𰸡����� > ���� ��С ��С ���� ���� 26.����@>@����@��С@��С@����@����@��dz
��������
���⿼����������ԭ������1�������¶ȣ�B��ת���ʱ��˵����Ӧ������Ӧ������У�������Ӧ����Ϊ���ȷ�Ӧ�����淴ӦΪ���ȷ�Ӧ����Сѹǿ��C������������С��˵����Ӧ���淴Ӧ������У���a��b>p����2��ƽ������B�����ӷ�Ӧ���Ũ�ȣ�ƽ��������Ӧ�����ƶ�����A��ת��������B���������ӣ���B�ĵ�ת���ʽ��ͣ���3������Ӧ�����ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���B�����ʵ�����С��C�����ʵ�������B��C��Ũ��֮�ȼ�С����4��ʹ�ô������Ի�ѧƽ����Ӱ�죬����������������ʵ������䣻��5��ƽ���ѹ���������������ֵ�Ũ�ȶ�����������ɫ�����ѹʱ������Ƿ�Ӧ���壬���������������ֵ�Ũ�Ƚ��ͣ�������ɫ��dz��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.̼��12 ԭ�Ӻ�̼��13 ԭ�ӵ���������ͬ
B.KMnO4 �� K2 MnO4 ������ͬ��ԭ����
C.Fe2+�� Fe3+��������Ԫ�أ������������ͬ
D. ��
�� ��ѧ��������
��ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����嫵ĺ�����һ��������ʱ��⣬��ҵ�ϳ���Ũ����ˮ��ȡ�壮

����˵������ȷ���ǣ�������
A.��ˮ�ĵ���������Ҫ�������������������ӽ�������
B.����������������ӷ�������
C.����۷�Ӧ�����ӷ���ʽΪBr2+SO2+2H2O�T2HBr+2H++SO42��
D.�٩���Ŀ����Ϊ�˸�����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪԭ���������������������Ԫ�ء���֪A��C��F��ԭ�ӵ�����㹲��11�����ӣ���������Ԫ�ص�����������ˮ����֮���������ܷ�Ӧ�����������κ�ˮ��DԪ��ԭ�ӵ������������ȴ�����������4����EԪ���⻯������2����ԭ�ӣ��Իش�
��1��д��Bԭ�ӽṹʾ��ͼ___
��2��Ԫ������������Ӧˮ�����м�����ǿ����___��д��һ�ֺ���FԪ�صľ���Ư���Ե�����___���û�ѧʽ��ʾ����
��3���õ���ʽ��ʾA��Fԭ���γɻ�����Ĺ���___��
��4��C��F����Ԫ������������ˮ����֮�䷴Ӧ�����ӷ���ʽ___��
��5�����ʵ��֤��E��F����Ԫ�طǽ����Ե�ǿ��___����ѧ����ʽ�ӱ�Ҫ����˵������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������˵��������ǣ� ��
A.�����ǻ���ɫ����
B.������ǿ�Ҵ̼�����ζ���ж�
C.������ʹ�������ɫ������ɫ
D.�����ǻ��õķǽ������ʣ����к�ǿ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ���ǣ� ��
A.������ɫ����ζ��Һ��
B.��������ˮ���ж���
C.������ʹ�������������Һ��ɫ
D.�ڴ��������£���������Һ�巢��ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�������ᣬ���������Լ���ҽ�÷���������������������һ���Ʊ��������Ƶ�ʵ�鷽�����ش��������⣺
��һ��̼��Ƶ��Ʊ�

��1�����������백ˮ��Ŀ����_______��С����е�������ʹ������������������____��
��2����ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����______�����ţ���

a��©��ĩ�˾���δ�����ձ���
b����������������
c������ֽʪ��ʹ�����©����
d����ֽ��Ե�߳�©��
e���ò�������©������������Լӿ�����ٶ�
(��)�������Ƶ��Ʊ�

��3���������ľ������Ϊ��μ���ϡ���ᣬ����Һ���д����������壬��ʱ��Һ��____�ԣ���������������������������������Һ��У����ȹ��ˡ�����Һ��е�������___________��
��4���������з�Ӧ�Ļ�ѧ����ʽΪ________���÷�Ӧ��Ҫ�ڱ�ԡ�½��У�ԭ����_________��
��5�������˵õ��İ�ɫ�ᾧ����ʹ������ˮ���Ҵ�ϴ�ӣ�ʹ���Ҵ�ϴ�ӵ�Ŀ����_______��
��6���Ʊ��������Ƶ���һ�ַ����ǣ���ʯ��ʯ���պ�ֱ�Ӽ���˫��ˮ��Ӧ�����˺�ɵõ��������Ʋ�Ʒ���ù��շ������ŵ���______����Ʒ��ȱ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����Ͷ�������Ĵ������ϵͳ���ŵ�ǰ����Ĥ�����ĵ����ΪNa2S2��NaBr3���ŵ��ֱ��ΪNa2S4��NaBr������������ȷ����
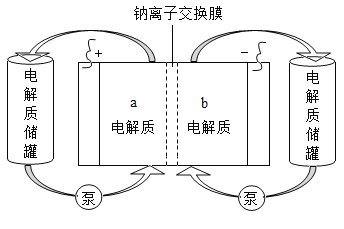
A. �ŵ�ʱ��������ӦΪ3NaBr - 2e-=== NaBr3 + 2Na+
B. ���ʱ��������ӦΪ2Na2S2 - 2e -=== Na2S4 + 2Na+
C. �ŵ�ʱ��Na+�������ӽ���Ĥ����a������b��
D. �øõ�ص�ⱥ��ʳ��ˮ������0.1molH2ʱ��b������17.40 gNa2S4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��ϩ�������¶ȹ��߶�ʹ�Ҵ���ŨH2SO4��Ӧ���������Ķ������������������ʵ����ȷ�������������������ϩ�Ͷ���������װ������ͼ��ʾ���Իش��������⡣

(1)ͼ�Т١��ڡ��ۡ���װ�ÿ�ʢ�ŵ��Լ���
��________����________����________����________��(�������й��Լ����������ո���)
A��Ʒ����Һ B��NaOH��Һ
C��ŨH2SO4 D������KMnO4��Һ
(2)��˵����������������ڵ�������_____________��
(3)ʹ��װ�âڵ�Ŀ����___________��ʹ��װ�â۵�Ŀ����____________��
(4)��˵��������ϩ��������____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com