
【题目】某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8.若配置该营养液,取214gNH4Cl,则需KCl和K2SO4的质量分别为( )
A.53.5g和214gB.37.25g和348g
C.74.5g和696gD.149g和696g
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】化合物A(仅含三种元素,摩尔质量为198g·mol-1)具有高效的消毒作用,是一种新型非氮高效消毒剂。为探究化合物A的组成与性质,设计并完成以下实验:取3. 96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL 0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g。将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐。
(1)化合物A所含有的元素:_______________(用元素符号表示)。
(2)化合物A与H2O反应的离子方程式:__________________。
(3)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳﹣12 原子和碳﹣13 原子的中子数相同
B.KMnO4 和 K2 MnO4 中有相同的原子团
C.Fe2+和 Fe3+都属于铁元素,核外电子数不同
D. 和
和 化学性质相似
化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知1g3=0.48)
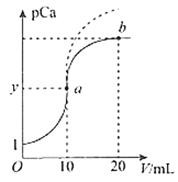
A. y值为3.48
B. a与b两点c(Ca2+)之比为50:3
C. 原CaCl2溶液浓度为1mol/L
D. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“未来金属”钛的信息有:①硬度大②熔点高③常温下耐酸碱、耐腐蚀,由钛铁矿钛的一种工业流程为:

(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价___价,反应①化学方程式为___。
(2)反应②的化学方程式为TiO2+C+Cl![]() TiCl4+CO(未配平),该反应中每消耗12gC,理论上可制备TiCl4___g。
TiCl4+CO(未配平),该反应中每消耗12gC,理论上可制备TiCl4___g。
(3)TiCl4在高温下与足量Mg反应生成金属Ti,反应③化学方程式___,该反应属于___(填基本反应类型)
(4)上述冶炼方法得到的金属钛中会混有少量金属单质是___(填名称),由前面提供的信息可知,除去它的试剂可以是以下剂中的___(填序号)
A HCl BNaOH CNaCl DH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.

下列说法不正确的是( )
A.海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等
B.步骤②中体现了溴易挥发的性质
C.步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42﹣
D.①﹣④目的是为了富集溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大第三周期元素。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素氢化物中有2个氢原子,试回答:
(1)写出B原子结构示意图___
(2)元素最高价氧化物对应水化物中碱性最强的是___,写出一种含有F元素的具有漂白性的物质___(用化学式表示)。
(3)用电子式表示A、F原子形成化合物的过程___。
(4)C、F两种元素最高价氧化物的水化物之间反应的离子方程式___。
(5)设计实验证明E、F两种元素非金属性的强弱___(化学方程式加必要文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是
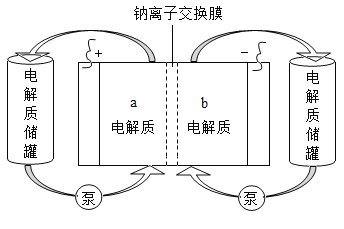
A. 放电时,负极反应为3NaBr - 2e-=== NaBr3 + 2Na+
B. 充电时,阳极反应为2Na2S2 - 2e -=== Na2S4 + 2Na+
C. 放电时,Na+经过离子交换膜,由a池移向b池
D. 用该电池电解饱和食盐水,产生0.1molH2时,b池生成17.40 gNa2S4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com