
【题目】已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知1g3=0.48)
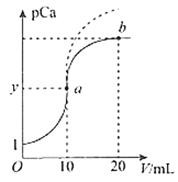
A. y值为3.48
B. a与b两点c(Ca2+)之比为50:3
C. 原CaCl2溶液浓度为1mol/L
D. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分
【答案】D
【解析】
A.未滴加Na2SO4溶液时pCa=1,可知原溶液中c(Ca2+)=0.1mol/L,a点为滴加10mL0.1mol/L的Na2SO4溶液,此时恰好完全反应,此时溶液中c(Ca2+)= c(SO42-)=![]() mol/L=3.0×10-3mol/L,pCa=-lgc(Ca2+)=-lg(3.0×10-3)=3-lg3=2.52,即y值为2.52,故A错误;B.a点溶液中c(Ca2+)=3.0×10-3mol/L,b点溶液中加入Na2SO4的体积为20mL,则溶液中c(SO42-)=
mol/L=3.0×10-3mol/L,pCa=-lgc(Ca2+)=-lg(3.0×10-3)=3-lg3=2.52,即y值为2.52,故A错误;B.a点溶液中c(Ca2+)=3.0×10-3mol/L,b点溶液中加入Na2SO4的体积为20mL,则溶液中c(SO42-)=![]() mol/L,则此时溶液中c(Ca2+)=
mol/L,则此时溶液中c(Ca2+)=![]() mol/L=2.7×10-4mol/L,所以a点和b点溶液中c(Ca2+)之比为(3.0×10-3mol/L):(2.7×10-4mol/L)=100:9,故B错误;C.未滴加Na2SO4溶液时pCa=1,可知原溶液中c(Ca2+)=0.1mol/L,原CaCl2溶液浓度为0.1mol/L,故C错误;D.CaSO4的溶解度比CaCO3的大,前者Ksp数值更大,因此在使用相同量的Na2CO3溶液代替Na2SO4溶液时,溶液中Ca2+下降的快,则pCa值相对较大,图象应在原图像上方,故D正确;故答案为D。
mol/L=2.7×10-4mol/L,所以a点和b点溶液中c(Ca2+)之比为(3.0×10-3mol/L):(2.7×10-4mol/L)=100:9,故B错误;C.未滴加Na2SO4溶液时pCa=1,可知原溶液中c(Ca2+)=0.1mol/L,原CaCl2溶液浓度为0.1mol/L,故C错误;D.CaSO4的溶解度比CaCO3的大,前者Ksp数值更大,因此在使用相同量的Na2CO3溶液代替Na2SO4溶液时,溶液中Ca2+下降的快,则pCa值相对较大,图象应在原图像上方,故D正确;故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用下列装置进行相关实验,操作正确且能达到实验目的的是

A. 甲装置:称30.0gNaOH固体 B. 乙装置:过滤除去溶液中的不溶性杂质
C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置:吸收实验室制NH3的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,合成氨反应:N2 (g ) + 3H2 ( g ) ![]() 2NH3 ( g ) △H =-92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H =-92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定小于92.0 kJ
C. 一定等于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
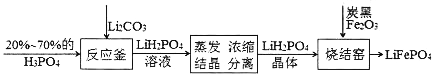
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
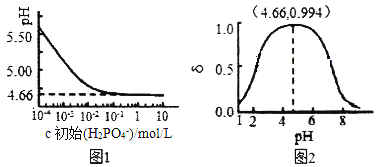
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用高锰酸钾和浓盐酸制取氯气,反应方程式如下:
[___]KMnO4+[___]HCl(浓)→[___]KCl+[___]MnCl2+[___]Cl2+[___]H2O
(1)配平上述反应的化学方程式,并用单线桥标出电子转移方向和数目。__________
(2)反应中,HCl 体现的化学性质为____。
(3)若反应消耗 2molHCl,转移电子数目为_____个。
(4)将SO2气体通入KMnO4溶液中,溶液褪色,生成Mn2+.写出发生反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8.若配置该营养液,取214gNH4Cl,则需KCl和K2SO4的质量分别为( )
A.53.5g和214gB.37.25g和348g
C.74.5g和696gD.149g和696g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
(1)在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
①当反应达到平衡时,N2和H2的浓度比是__________
②升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不”)移动。
④若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(2)该反应 N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

①t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1______________,t3_____________,t4___________。
②下列时间段中,氨的百分含量最高的是______
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)用“>”或“<”填写下表。
非金属性 | 熔点 | 沸点(同压) | 键能 |
P___S | MgO ___CaS | CF4 ___SiCl4 | H-Cl___H-Br |
(2)一种制取NH2OH的反应为2NO2-+4SO2+6H2O+6NH3=4S042-+6NH4++2NH2OH。
①N、H、O的电负性从小到大的顺序为____。
②NH2OH中N原子的杂化类型为____。
③NHOH极易溶于H2O,除因为它们都是极性分子外,还因为____。
(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为_____(不考虑空间构型),1molK[PtCl3(NH3)]中含有σ键的数目为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com