
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
(1)在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
①当反应达到平衡时,N2和H2的浓度比是__________
②升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③当达到平衡时,充入氩气,并保持压强不变,平衡将_______ (填“正向”、“逆向”或“不”)移动。
④若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将____________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(2)该反应 N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

①t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1______________,t3_____________,t4___________。
②下列时间段中,氨的百分含量最高的是______
A.0~t1 B.t2~t3 C.t3~t4 D.t4~t5
【答案】1:3 变小 逆向 向左移动 小于 升高温度 使用催化剂 减小压强 A
【解析】
(1)①加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,由于变化量之比也等于化学计量数之比,剩余的氮气和氢气的N2和H2的浓度比等于其物质的量之比,即1:3;综上所述,本题答案是:1:3。
②该反应放热,升温,平衡逆向移动,气体物质的量增大,质量不变,由于气体的平均相对分子质量![]() =m(总)/n(总) ,所以混合气体的平均相对分子质量变小;综上所述,本题答案是:变小。
=m(总)/n(总) ,所以混合气体的平均相对分子质量变小;综上所述,本题答案是:变小。
③充入氩气并保持压强不变,体积变大,相关气体的分压变小,相当于减小压强,平衡向体积增大的逆向移动;综上所述,本题答案是:逆向。
④升温,平衡向吸热的逆向移动,使体系温度降低,温度比原来温度高但是要小于原来的2倍;因此,本题正确答案是:向左移动;小于。
(2)由N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,可以知道,该反应为放热反应,且为气体体积减小的反应,则
2NH3(g)ΔH<0,可以知道,该反应为放热反应,且为气体体积减小的反应,则
①由图可以知道,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
由图可以知道,t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
由图可以知道,t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强;
因此,本题正确答案是:升高温度,使用催化剂,减小压强。
(2)由图可以知道,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则0~t1氨气的含量最大, A正确;因此,本题正确答案是:A。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知1g3=0.48)
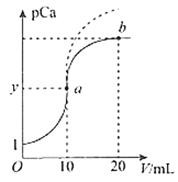
A. y值为3.48
B. a与b两点c(Ca2+)之比为50:3
C. 原CaCl2溶液浓度为1mol/L
D. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“未来金属”钛的信息有:①硬度大②熔点高③常温下耐酸碱、耐腐蚀,由钛铁矿钛的一种工业流程为:

(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价___价,反应①化学方程式为___。
(2)反应②的化学方程式为TiO2+C+Cl![]() TiCl4+CO(未配平),该反应中每消耗12gC,理论上可制备TiCl4___g。
TiCl4+CO(未配平),该反应中每消耗12gC,理论上可制备TiCl4___g。
(3)TiCl4在高温下与足量Mg反应生成金属Ti,反应③化学方程式___,该反应属于___(填基本反应类型)
(4)上述冶炼方法得到的金属钛中会混有少量金属单质是___(填名称),由前面提供的信息可知,除去它的试剂可以是以下剂中的___(填序号)
A HCl BNaOH CNaCl DH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.

下列说法不正确的是( )
A.海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等
B.步骤②中体现了溴易挥发的性质
C.步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42﹣
D.①﹣④目的是为了富集溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)煅烧成生石灰;②在引有海水的渠中加入生石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解获得产物。根据上述提取镁的全过程,没有涉及的反应类型是( )
A.分解反应B.化合反应
C.置换反应D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大第三周期元素。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素氢化物中有2个氢原子,试回答:
(1)写出B原子结构示意图___
(2)元素最高价氧化物对应水化物中碱性最强的是___,写出一种含有F元素的具有漂白性的物质___(用化学式表示)。
(3)用电子式表示A、F原子形成化合物的过程___。
(4)C、F两种元素最高价氧化物的水化物之间反应的离子方程式___。
(5)设计实验证明E、F两种元素非金属性的强弱___(化学方程式加必要文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯是无色、无味的液体
B.苯易溶于水,有毒性
C.苯可以使高锰酸钾酸性溶液褪色
D.在催化剂作用下,苯可以与液溴发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________。试写出NaHCO3溶液显碱性的的离子方程式________,
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______________。
(3)体积相同、pH相同的CH3COOH溶液和HClO溶液,与NaOH溶液中和时两者消耗NaOH的物质的量________(填字母)。
A.相同 B.中和CH3COOH的多
C.中和HClO的多 D.无法比较
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水 稀释至1 000 mL,稀释过程pH变化如图所示,则HX的电离常数 ________(填“大于”“等于”或“小于”)醋酸的电离常数。

(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______ (填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A ⑤A中有锌剩余 ⑥B中有锌剩余
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com