
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是( )
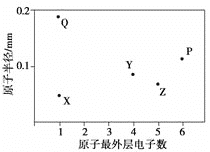
A.Q的氧化物一定含有离子键和共价键
B.含氧酸的酸性:Z>Y
C.P位于第三周期第VIA族
D.Y形成的化合物种类最多
【答案】CD
【解析】
由图中原子半径可知,Q>P>Y>Z>X,结合原子的最外层电子数可知,Q、X的最外层电子数均为1,则X为H,Q为Na;Y、Z位于第二周期,P位于第三周期符合半径的比较规律,Y的最外层电子数为4,Y为C;Z的最外层电子数为5,Z为N;P的最外层电子数为6,P为S,以此来解答。
由上述分析可知,X为H,Y为C,Z为N,P为S,Q为Na。
A.Q的氧化物为Na2O、Na2O2,Na2O中只含离子键,不含共价键,A错误;
B.元素的非金属性N>C,则最高价含氧酸的酸性:Z>Y,题目未指出是比较最高价含氧酸,因此不能比较酸性强弱,B错误;
C.P是S元素,其在元素周期表中位于第三周期第VIA族,C正确;
D.Y为C,C可形成4个化学键,可以形成共价单键、双键、三键,既可以形成碳链,也可以形成碳环;即可以形成直连,还可以形成支链。成键方式多样,且有机物存在同分异构体,形成有机物种类最多,D正确;
故合理选项是CD。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
A.若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大
B.若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动
C.若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色
D.若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是
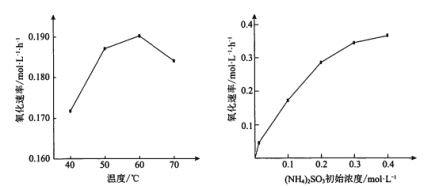
A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O35H2O反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
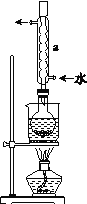
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是_________,其作用是__________________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是________。检验是否存在该杂质的方法是________________________________。
(3)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 molL-1碘的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
(4)滴定至终点时的判断依据是___________________________。
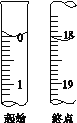
(5)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_______mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M)_________。(用含M的式子表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
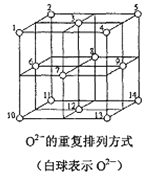
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)、 锰(Mn)、铁(Fe)、 砷(As)、硒(Se)均为第四周期的元素,完成下列问题。
(1)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(2)基态Fe2+的价层电子的轨道表示式为________,检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下:
Mn:![]() =717kJ/mol ,
=717kJ/mol ,![]() =1509kJ/mol ,
=1509kJ/mol ,![]() =3248kJ/mol ,
=3248kJ/mol ,
Fe:![]() =759kJ/mol,
=759kJ/mol,![]() =1562kJ/mol ,
=1562kJ/mol ,![]() =2957kJ/mol ,
=2957kJ/mol ,
根据数据可知,气态Mn2+ 再失去一个电子比气态Fe2+ 再失去一个电子难,其原因是____________________。
(4)沸点:NH3__________AsH3(填“>”、“<”或“=”),原因是_____________________。
(5)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因___________________________________ 。
(6)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
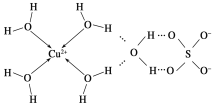
胆矾的化学式用配合物的形式表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。
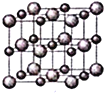
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物Ⅰ的说法,正确的是___。

A.可能发生酯化反应和银镜反应
B.化合物Ⅰ含有5种官能团
C.1mol化合物Ⅰ在一定条件下最多能与7molH2发生加成反应
D.能与溴发生取代和加成反应
(2)下面反应是一种由烯烃直接制备不饱和酯的新方法。
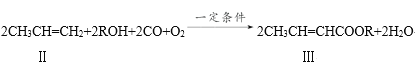
化合物Ⅲ与足量的NaOH溶液共热的化学方程式为__;反应类型是__。
(3)2—丁烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
CH4+CO![]() CH3CHO(A)
CH3CHO(A)![]() B
B![]() CH3CH=CHCOOH(D)
CH3CH=CHCOOH(D)![]() E
E
已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
①B中官能团的名称为___。
②E的结构简式为___。
③试剂C可选用下列中的___。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
④B在一定条件下可以生成高聚物F,该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 通入 BaCl2 溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧 Y 形管中放置的药品组合符合要求的是( )
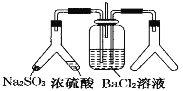
①Cu 和浓硝酸 ②氢氧化钠固体和浓氨水 ③大理石和稀盐酸 ④过氧化氢和二氧化锰
A. ①②④B. 全部C. ②③D. ①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com