
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
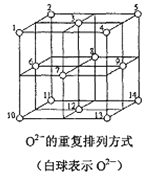
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
【答案】 3d64s2 铁(或Fe) 三角锥形 sp3 分子 配位键、共价键 > 相同电荷的离子,半径越小,离子间的静电作用力越大,离子晶体的晶格能越大 2∶1 50% ![]() ×1010
×1010
【解析】(1)铁是26号元素,基态铁原子的价电子排布式为3d64s2。钴、镍的基态原子的价电子排布式分别为3d74s2、3d84s2,三种元素原子的核外未成对电子数分别为4、3、2,未成对电子数最多的是铁,故答案为:3d64s2;铁;
(2)在[Co(NH3)6]Cl3晶体中配体分子是氨气分子,氨气分子中N原子的价层电子对个数=3+ ![]() (5-3×1)=3+1=4,立体构型是三角锥形,其中心原子的杂化轨道类型为sp3,故答案为:三角锥形;p3;
(5-3×1)=3+1=4,立体构型是三角锥形,其中心原子的杂化轨道类型为sp3,故答案为:三角锥形;p3;
(3)Fe(CO)5的熔点为253K,沸点为376K,熔沸点较低,因此Ni(CO)4的熔沸点也较低,Ni(CO)4固体属于分子晶体,存在的化学键有配位键、共价键,故答案为:分子;配位键、共价键;
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,所以熔点是NiO>FeO,故答案为:>;相同电荷的离子,半径越小,离子间的静电作用力越大,离子晶体的晶格能越大;
(5)结构中如1、3、6、7的O2-围成的正四面体空隙有8个,由图可知晶体结构中O2-离子数目为8×![]() +6×
+6×![]() =4,故正四面体空隙数与O2-离子数目之比8:4=2:1;Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,有50%的正八面体空隙没有填充阳离子。图示结构中O2-离子数目为8×
=4,故正四面体空隙数与O2-离子数目之比8:4=2:1;Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,有50%的正八面体空隙没有填充阳离子。图示结构中O2-离子数目为8×![]() +6×
+6×![]() =4,则含有Fe3+和Fe2+的总数为3,晶胞中有8个图示结构单元,1mol晶胞的质量为8×(3×56+4×16)=8×232g,则晶体密度=
=4,则含有Fe3+和Fe2+的总数为3,晶胞中有8个图示结构单元,1mol晶胞的质量为8×(3×56+4×16)=8×232g,则晶体密度=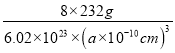 =5.18g/cm3,a=
=5.18g/cm3,a=![]() ×1010,故答案为:2∶1;50%;
×1010,故答案为:2∶1;50%; ![]() ×1010。
×1010。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物,它的合成路线如下:

(1)由B→C的反应类型为____________________。
(2)B分子中有2个含氧官能团,分别为__________和__________(填官能团名称)。
(3)写出A与溴水反应的化学方程式______________________________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:____________________。
①属于a-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有一种。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷。
完成以邻甲基苯酚( )和乙醇为原料制备
)和乙醇为原料制备 的合成路线流程图。
的合成路线流程图。
①结合题中信息;无机试剂任用。
②合成路线流程图中,在(______)填反应条件,在[ ]填反应物或生成物的结构简式:

③写出邻甲基苯酚与乙醛合成高分子的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要能源,人类正面临着石油短缺、油价上涨的难题。下列解决能源问题的方法不当的是
A. 鼓励个体企业加快煤炭的开采 B. 研究和开发利用太阳能
C. 建造水电站开发水利资源 D. 开发研制可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )
A.2F2+2H2O=4HF+O2↑
B.2Na+2H2O=2NaOH+H2↑
C.C12+H2O=HC1O+HC1
D.C+H2O ![]() CO+H2
CO+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()

A. N4的熔点比P4高
B. 1 mol N4气体转化为N2时要吸收724 kJ能量
C. N4是N2的同系物
D. 1 mol N4气体转化为N2时要放出724 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:

已知;RCHO+CH3CHO![]() RCH(OH)CH2CHO。试回答:
RCH(OH)CH2CHO。试回答:
(1)A的化学名称是________,A→B的反应类型是________ 。
(2)B→C反应的化学方程式为________ 。
(3)C→D所用试剂和反应条件分别是________ 。
(4)E的结构简式是_________。F中官能团的名称是________ 。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有____种。其中苯环上只有一个取代基,核磁共振氢谱有5个峰,峰面积比为2:1:2:2:1的同分异构体的结构简式为________ 。
(6)写出用乙醇为原料制备2-丁烯醛的合成路线(其他试剂任选) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( ) 
A.a点对应的溶液中:Na+、OH﹣、SO42﹣、NO3﹣
B.b点对应的溶液中:Al3+、Fe3+、SCN﹣、Cl﹣
C.c点对应的溶液中:Na+、Ca2+、NO3﹣、Cl﹣
D.d点对应的溶液中:SO32﹣、Na+、Cl﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com