
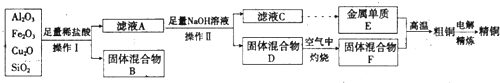
分析 矿渣和盐酸反应,氧化铝、氧化亚铜和氧化铁与盐酸反应生成氯化物,氧化亚铜和盐酸反应生成氯化铜和铜,二氧化硅和盐酸不反应,所以固体混合物B有铜和二氧化硅,滤液A含有氯化亚铁、氯化铜和氯化铝;向滤液A中充入过量氢氧化钠,生成氢氧化铁、氢氧化铜沉淀,同时生成偏铝酸钠,所以固体混合物D是氢氧化铁和氢氧化铜,滤液C是偏铝酸钠和氢氧化钠溶液;氢氧化铁和氢氧化铜在空气中灼烧生成氧化铜和氧化铁,所以固体混合物F是氧化铜和氧化 铁;偏铝酸钠溶液得到的单质E是金属铝.
(1)根据分离溶液和沉淀;根据灼烧过程所需要用到的仪器分析即可;
(2)依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,Cu2O与盐酸反应生成氯化铜、铜和水,生成的铜能与氯化铁反应生成氯化亚铁和氯化铜,二氧化硅不溶于盐酸为沉淀;三价铁离子与KSCN溶液发生反应生成红色物质来检验三价铁离子;
(3)根据铝热反应的原理来书写;
(4)设溶液的PH为X,然后求出由水电离出的c(OH-),利用由水电离出的c(OH-)前者为后者的108倍求出X;
(5)①a.电能转化为化学能、热能;
b.粗铜接电源正极,失去电子,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量存在关系;
②要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.
解答 解:(1)实验操作I步骤中分离溶液和沉淀的操作名称为过滤,在空气中灼烧固体混合物D时,所用到的仪器有坩埚、泥三角、三角架、酒精灯,玻璃棒,
故答案为:过滤;坩埚;
(2)依据提取流程图可知,加入过量盐酸,氧化铁和氧化铝全部溶解为氯化铁和氯化铝溶液,Cu2O与盐酸反应生成氯化铜、铜和水,生成的铜能与氯化铁反应生成氯化亚铁和氯化铜,方程式为:2FeCl3+Cu═2FeCl2+CuCl2,二氧化硅不溶于盐酸为沉淀,所以滤液A中铁元素的存在形式为亚铁离子,可用氯水将其氧化成三价铁离子,三价铁离子与KSCN溶液发生反应生成红色物质来检验三价铁离子,
故答案为:Fe2+;2Fe3++Cu═2Fe2++Cu2+;KSCN溶液、氯水;
(3)铝与氧化铁发生铝热反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(4)设溶液的PH为X,NaAlO2溶液中由水电离出的c(OH-)=10X-14mol/L,NaOH溶液中由水电离出的c(OH-)=10-Xmol/L,$\frac{10{\;}^{X-14}}{10{\;}^{-X}}$=108,解得X=11,故答案为:11;
(5))①a.电能部分转化为化学能,故a错误;
b.粗铜接电源正极,失去电子,发生氧化反应,故b正确;
c.精铜作阴极,电解后电解液中Cu2+浓度减小,故c正确;
d.粗铜精炼时通过的电量与阴极析出铜的量存在关系:电路中通过3.01×1023个电子,得到精铜的质量为16g,故d错误;
故选:bc;
②要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后.
点评 本题以矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜为背景,主要考查了物质的性质、化学方程式、电解原理等,难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于d | |
| B. | 若从正反应开始平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 若平衡体系中气体M mol,再充入bmolB,达到平衡气体量为(M+b)mol,则a+b=c+d | |
| D. | 若a+b=d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁中加入盐酸:S2-+2H+═H2S↑ | |
| B. | 向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 硫酸铝溶液和少量苏打溶液反应:3H2O+Al3++3CO32-═3HCO3-+Al(OH)3↓ | |
| D. | 钠和冷水反应:2Na+2H2O═2Na++H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药 | |
| B. | 对燃煤进行脱硫处理 | |
| C. | 对塑料等垃圾进行深埋或倾倒入海处理 | |
| D. | 推广使用节能环保材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | NH4HCO3溶液中加入过量的NaOH溶液并加热:HCO3-+OH+$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+H2O | |
| C. | 稀硝酸除银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2═2Fe3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com