
 .
. 分析 (1)2-丁烯中含有碳碳双键,和溴单质加成反应生成2,3-二溴丁烷;
(2)碳化钙与水反应生成乙炔气体和氢氧化钙;
(3)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯.
解答 解:(1)2-丁烯中含有碳碳双键,2-丁烯和溴单质加成反应生成2,3-二溴丁烷,反应方程式为:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3,
故答案为:CH3-CH=CH-CH3+Br2→CH3-CHBr-CHBr-CH3;
(2)实验室中用碳化钙与水发生水解反应,生成乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(3)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,化学反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机化学反应方程式的书写,为高频考点,把握发生的化学反应及官能团与性质的关系为解答的关键,注意有机反应条件及反应类型,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 500 mL 1 mol•L-1的KNO3溶液 | |
| B. | 500 mL 1 mol•L-1的Ba(NO3)2溶液 | |
| C. | 1000 mL 0.5 mol•L-1的Mg(NO3)2溶液 | |
| D. | 1000 mL 0.5 mol•L-1的Fe(NO3)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品就是指颜色为绿色的食品 | B. | 有机食品是指含有机物的食品 | ||
| C. | OTC表示处方药 | D. | 加碘盐是在食盐中加入KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| $\frac{溶解度}{g/100g{H}_{2}O}$ | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在能源开发与利用中起着十分重要的作用.
化学在能源开发与利用中起着十分重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
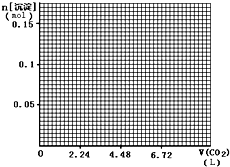 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 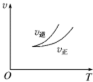 依据图可判断正反应为放热反应 | |
| B. | 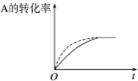 在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 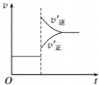 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 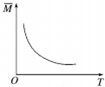 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com