
【题目】将生铁炼成钢的主要目的是( )
A.适当增加生铁中碳的含量
B.除去铁中的碳、硫和磷
C.适当增加铁中硫和磷的含量
D.适当降低含碳量并除去大部分的硫和磷
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氢氧化铝能与酸反应 | 用作抗酸药 |
C. | 明矾易溶于水 | 可作净水剂 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤块粉碎,经脱硫处理,在适当过量的空气中燃烧,这样处理的目的是( )
①使煤充分燃烧,提高煤的利用率;②减少二氧化硫的产生,避免造成“酸雨”;③减少有毒的一氧化碳产生,避免污染空气;④减少二氧化碳的产生,避免“温室效应”。
A.①②③
B.②③④
C.①③④
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的5种短周期元素。A是最轻的金属,B的最低负化合价的绝对值比最高正化合价少2,C的简单阴离子C2-与氖原子有相同的电子层结构,D与A同主族,E的M层电子数比L层少2个。
(1)写出元素符号:A______、C______,E在元素周期表中的位置是________________;
(2)C、D、E原子半径由大到小:______(写元素符号,后同),C、D、E简单离子的半径由大到小_____;
(3)A常用作电池的电极材料,含A的电池通常采用非水电解质或固体电解质,原因是______(用化学方程式解释);
(4)B与氢元素可以形成10电子微粒X和18电子微粒Y,Y是一种良好的火箭燃料。X中含有的共价键类型是_______,Y的电子式为_________;
(5)C的两种单质在常温下都是气体,它们互为____________。比较C的氢化物和E的氢化物沸点:C___E(填“>”“<”或“=”),原因是____________
(6)用电子式表示D与E的二元化合物的形成过程:________________,碳原子与E能形成AB2型化合物,请写出该物质的电子式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R的最简单气态氢化物分子的空间结构为正四面体,X的+1价阳离子的电子层结构与氖原子相同。元素X和Z形成化合物G,G中X和Z元素的质量之比为 23:16.含Y元素的可溶性化合物E和含X的可溶性化合物F,在10mL 1.0molL﹣1 E 溶液中滴加1.0molL﹣1 F溶液,产生沉淀的物质的量(n)与F溶液体积(V)的关系如图所示。下列说法一定正确的是( )
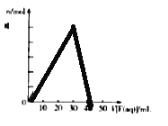
A. 原子半径:X>Y>R
B. 最高价氧化物对应水化物的酸性:Z>Y>R
C. X和Y的单质组成的混合物不能完全溶于水
D. 工业上,通过电解熔融氯化物制备Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.电解得到的Cu的物质的量为0.5mol
B.向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C.原混合溶液中c(K+)=4mol/L
D.电解后溶液中c(H+)=2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属钠熔化 ②在空气中燃烧,放出紫色火花 ③燃烧后得到白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色的固体物质,描述正确的是
A. ①② B. ①②③
C. ①④ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 对于吸热反应,生成物总能量一定低于反应物总能量
B. 石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C. 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D. 4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别为243kJ/mol和498kJ/mol,则可推算出H-O键的键能比H-Cl键的键能大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com