
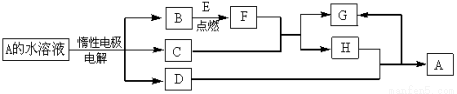
(14分)D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图:
(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧热的热化学方程式______。
(2)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
A.氯水和KSCN溶液 B.氢氧化钠溶液 C.酸性KMnO4溶液
(3)用惰性电极电解一定浓度的A的水溶液,阳极反应式为_____________________,通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度和pH,则电解过程中收集到标准状况下的气体体积为__________。
(4)假设用以铂做电极,KOH溶液为电解质溶液的肼(N2H4)——空气燃料电池作为本过程的电源,则放电时的负极反应式 (生成物均无污染)。
(1)Fe(s)+2/3O2(g)=1/3Fe3O4(s)△H=-56QkJ/mol (3分) (2)C (2分)
(3)4OH--4e-=2H2O +O2↑(3分);1.12L (3分) (4) N2H4-4e-+4OH-=N2↑+4H2O (3分)
【解析】
试题分析:D、E为中学化学常见的金属单质,E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H,这说明C是浓硫酸,E是铝或铁。B与E在点燃的条件下反应生成F,F是一种黑色晶体,所以E应该是铁,F是四氧化三铁,B是氧气。硫酸与四氧化三铁反应生成G和H。D与H反应生成A和G,则D是铜,H是硫酸铁,A是硫酸铜,G是硫酸亚铁。
(1)已知1g 铁在氧气中燃烧放出的热量为Q kJ,则1mol铁即56g铁在氧气中完全燃烧放热是56QkJ,所以表示E燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)△H=-56QkJ/mol。
(2)亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,则检验H和G的混合溶液中含有G的阳离子的试剂可以是酸性KMnO4溶液,答案选C。
(3)电解池中阳极失去电子,则用惰性电极电解一定浓度的硫酸铜的水溶液,阳极反应式为4OH--4e-=2H2O +O2↑;通电一段时间后,向所得溶液中加入8.0g CuO后恰好恢复到电解前的浓度和pH,这说明电解过程中生成铜是8g÷80g/mol=0.1mol,所以生成的氧气是0.1mol÷2=0.05mol,标准状况下的气体体积为0.05mol×22.4L/mol=1.12L。
(4)原电池中负极失去电子,发生氧化反应,则肼在负极通入,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O。
考点:考查无机框图题推断的有关应用
考点分析: 考点1:无机框图推断 试题属性

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2014-2015学年山东省烟台市高三下学期一模诊断测试理科综合化学试卷(解析版) 题型:选择题
在指定溶液中一定能大量共存的离子组是
A.1.0mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
B.pH=1的溶液:NH4+、Al3+、SO42-、Br-
C.c(ClO-)=1.0mol·L-1的溶液:Na+、SO32-、S2-、Cl-
D.与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数,下列叙述正确的是
A.24g镁原子最外层电子数为NA
B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C.1mol甲烷分子所含质子数为10NA
D.标准状况下,22.4L乙醇的分子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期3月月考理综化学试卷(解析版) 题型:填空题
(16分)A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5。请回答下列问题(用相应的元素符号、化学式和化学术语填空)
(1)G在周期表中的位置是____,F元素的原子基态价层电子排布式__ 。
(2)BD2分子的电子式为__________,CA3分子的空间立体构型为__________。
(3)A元素分别与B、D元素形成的两种微粒H、I都具有N2H4相似的结构,属于等电子数微粒,它们的化学式分别是H:__________、I:__________。
(4)向G的硫酸盐溶液中逐滴加入足量的氨水至得到的沉淀完全溶解,再向该溶液中加入一定量乙醇,析出一种深蓝色晶体。在该晶体中存在的化学键的种类有__________。
(5)0.3g H在足量氧气中燃烧,生成气态CO2和液态H2O,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。
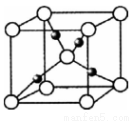
(6)G的一种氧化物的晶胞结构如图所示(黑球代表G原子),该氧化物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期3月月考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸性高锰酸钾溶液与草酸溶液的反应速率是先慢后快再变慢
B.碳酸钠是发酵粉的主要成分,而碳酸氢钠是治疗胃穿孔的一种药剂
C.一般用稀的(NH4)2SO4溶液分离提纯鸡蛋清溶液
D.工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:选择题
A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中AC和BD的盐溶液的pH=7,BC盐溶液pH>7,则下列说法正确的是:
A、AD盐溶液pH>7
B、酸的电离程度一定是HD<HC
C、碱的电离程度一定是AOH>BOH
D、在AC盐溶液中c(A+)+ c(AOH)= c(C-)+ c(HC)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:填空题
(15分)能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化:
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(3)某化学兴趣小组构想将NO转化为HNO3,装置如下图,电极为多孔惰性材料。则负极的电极反应式是 。

(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
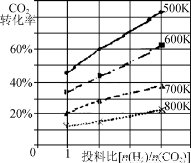
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 操 作 | 可能的现象 | 结 论 |
A | 向某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
B | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和 Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3﹥Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4  2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
据此,下列说法不正确的是
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.每1 mol ClO2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com