
【题目】设NA为阿伏加德罗常数的数值。下列叙述正确的是
A. 1molAlCl3在熔融状态时含有的离子总数为0.4NNA
B. 1molOH-与17gNH3所含的电子数分别为9NA和10NA
C. 常温常压下,0.1molNH3与0.1molHCl充分反应后所得的产物中含有的分子数为0.1NA
D. 13.8gNO2与足量水反应,转移的电子数为0.2NA
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
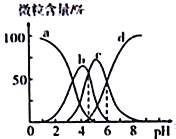
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏德罗常数的值,下列叙述正确的是
A.物质的量是一个物理量,它的单位是个
B.常温常压下,11.2 L H2所含的分子数为0.5 NA
C.1 mol 水的质量是18 g
D.MgCl2的摩尔质量为95
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有着广泛的应用。现将设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y是两块电板板,则:

(1)若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是________________________。
(2)若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质的电解总反应方程式为:________________,将其露置在空气中可观察到的现象为______。
(3)若X和Y均为情性电板,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2,恰好恢复电解前的浓度,则电解过程中转移的电子的物质的量为______。
(4)某同学为了使反应2HCl+2Ag=2AgC1+H2↑能在上述装置中进行,则电解液及电极分别为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人的纯净胃液是一种无色而呈酸性的液体,pH在0.9~1.5之间,胃液中含有大量盐酸,其中的H+浓度比血液高几百万倍,试回答下列问题:
①若胃液酸度增高就患胃酸过多症,下列物质不宜用作治疗胃酸过多症药物的主要成分的是(____)
A.小苏打粉 B.氢氧化铝粉 C.氧化钙粉 D.纯碳酸钙粉
②胃溃疡患者胃酸过多可考虑选用①中的 ________________。(填字母编号)写出反应的化学方程式______________________________ 。
(2)现有下列四种物质:A.食盐B.食醋 C.苹果汁 D.葡萄糖,请按下列要求填空(填序号)。
富含维生素C的是_________;可直接进入血液补充能量的是_________;即可作为调味剂,又可预防感冒的是_________;食用过多会引起血压升高、肾脏受损的________。
(3)保护环境、呵护地球已成为为类共同的呼声。
①水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是__________(填字母编号);
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃。根据垃圾分类方法,矿泉水瓶属于__________(填“可回收物”或“可堆肥垃圾”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验: (ⅰ)取三支试管,标记为I、II、III,I中盛有适量蒸馏水,II中盛有适量蒸馏水和植物油,III洁净干燥
(ⅱ)在三支试管中各放入一根无锈铁钉.并将II和III用软木塞塞紧,III中放入一小团棉花(如图所示).请回答:
(1)三支试管中铁钉锈蚀的速度从高到低依次排列为 由此可以得出铁钉锈蚀的条件有和 .
若该同学将I放在每天阳光直晒的阳台上,与避光保存相比,哪种保存方法锈蚀更快?这说明锈蚀速度与什么因素有关?
若该同学将I中的液体换做食盐水,对锈蚀的速率有何影响?这说明锈蚀速率还和什么因素有关? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液,②乙醇和丁醇,③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com