
【题目】室温下,用0.20mol·L-1的NaOH溶液滴定10.00mL 0.20mol·L-1的NaHSO3溶液,滴定过程中溶液的pH变化和滴加NaOH溶液的体积关系如图所示。下列说法错误的是( )

A.溶液中水的电离程度:b>a>c
B.pH=7时,消耗的V(NaOH)<10.00mL
C.在室温下K2(H2SO3)约为1.0×10-7
D.c点溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【答案】D
【解析】
在a点,pH<7,说明溶液显酸性,HSO3-主要发生电离,HSO3-![]() H++SO32-;在b点,加入
H++SO32-;在b点,加入
V(NaOH)=10.00mL,NaHSO3与NaOH的物质的量相等,二者刚好完全反应生成Na2SO3,此时c(Na2SO3)=0.1mol/L,溶液的pH=10,说明SO32-+H2O![]() HSO3-+OH-;在c点,V(NaOH)=20.00mL,此时溶液中c(Na2SO3)=c(NaOH)=0.067mol/L。
HSO3-+OH-;在c点,V(NaOH)=20.00mL,此时溶液中c(Na2SO3)=c(NaOH)=0.067mol/L。
A.在a点,HSO3-![]() H++SO32-,对水的电离产生抑制,b点,SO32-+H2O
H++SO32-,对水的电离产生抑制,b点,SO32-+H2O![]() HSO3-+OH-,促进水的电离,在c点,虽然SO32-仍会促进水电离,但过量NaOH对水电离的抑制是主要的,且比a点对水的抑制作用更强,水的电离程度更小,所以溶液中水的电离程度:b>a>c,A正确;
HSO3-+OH-,促进水的电离,在c点,虽然SO32-仍会促进水电离,但过量NaOH对水电离的抑制是主要的,且比a点对水的抑制作用更强,水的电离程度更小,所以溶液中水的电离程度:b>a>c,A正确;
B.V(NaOH)=10.00mL 时,pH>7,所以pH=7时,消耗的V(NaOH)<10.00mL,B正确;
C.在b点,SO32-+H2O![]() HSO3-+OH-,c(OH-)=c(HSO3-)=
HSO3-+OH-,c(OH-)=c(HSO3-)=![]() =
=![]() =1.0×10-4molL-1,Kh=
=1.0×10-4molL-1,Kh=![]() ≈10-7,在室温下K2(H2SO3)=
≈10-7,在室温下K2(H2SO3)=![]() =
=![]() ≈1.0×10-7,C正确;
≈1.0×10-7,C正确;
D.在c点,c(Na2SO3)=c(NaOH),溶液中主要发生SO32-+H2O![]() HSO3-+OH-,所以c(Na+)>c(OH-)>c(SO32-)>c(HSO3-)>c(H+),D错误;
HSO3-+OH-,所以c(Na+)>c(OH-)>c(SO32-)>c(HSO3-)>c(H+),D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
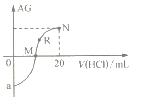
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒可防止人体因氧化而引起的衰老、组织硬化。回答下列问题:
(1)写出基态硒(Se)原子的价电子排布式____________;其中未成对电子数为_________;
(2)砷(As)和硒(Se)的第一电离能较大的是__________________;
(3)SeF2的立体构型为______________,Se原子的杂化方式为____________________;
(4)H2Se和H2O的熔沸点较高的是_________,原因是___________________________;
![]()
(5)Se和Zn组成的某种晶胞如图所示,则该晶体的化学式为________________,若已知该晶胞的密度为ρg/cm3,则该晶胞的棱长a=_______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-![]() H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=5.0×10-3),下列有关说法中正确的是( )
A.H2A是弱酸
B.稀释0.1 mol·L-1 H2A溶液,因电离平衡向右移动而导致c(H+)增大
C.若0.1 mol·L-1 NaHA溶液中c(H+)=0.02 mol·L-1,则0.1 mol·L-1的H2A中c(H+)<0.12 mol·L-1
D.在0.1 mol·L-1的H2A溶液中,c(H+)=0.12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是
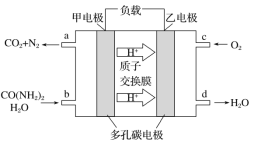
A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O+6e-===CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗标况下氧气33.6 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为________(用化学式表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_____________。
(3)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A、B两个恒容密闭容器中发生反应:2NO22NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示:
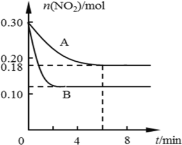
(1)若A容器的体积为5 L,反应经6 min达到平衡状态,则0~6 min内以O2浓度变化表示的反应速率为___________。
(2)该反应化学平衡常数K=__________(写出表达式)。
(3)说明该反应已达到平衡状态的是_______。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(4)若A、B两容器中只是温度不同,则TA____TB (填“>”或“<”),请写出一条能提高二氧化氮转化率的措施_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】骨胶黏剂是一种极具应用前景的医用高分子材料。某骨胶黏剂的制备原料为聚酯三元醇,其合成原理如下:
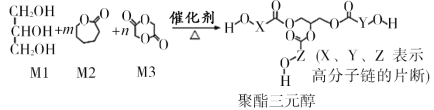
已知:R1COOR2+R318OH![]() R1CO18OR3+R2OH
R1CO18OR3+R2OH
下列说法正确的是
A.单体Ml可用于配制化妆品,且分子中含有3个手性碳原子
B.改变Ml在三种单体中的比例,可调控聚酯三元醇的相对分子质量
C.该合成反应为缩聚反应
D.X、Y、Z中包含的结构片段可能有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com