
【题目】在固态金属氧化物燃料电池中,以H2-CO混合气体为燃料,基本原理如图所示。下列说法不正确的是
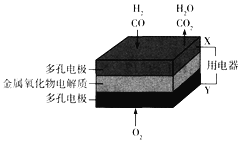
A. X极是原电池的负极,发生氧化反应
B. 负极的电极反应式为H2+O2--2e-===H2O、C O + O 2--2e-===CO2
C. Y极每消耗16gO2,电路中有2mol电子通过
D. 同温同压下两极消耗的气体体积之比是1:1
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,被氧化和被还原的原子的物质的量之比是
A. 1:6 B. 5:1 C. 6:1 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KC1O3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为_________________________________________________________。
(2)反应②中,氧化产物与还原产物的质量比为____________________________。
(3)请将反应③配平:_____KMnO4+_____HCl(浓)=_____KCl+____MnCl2+_____Cl2↑+_____H2O
(4)若要制得相同质量的氯气,反应中电子转移的数目之比(①:②:③)为___________________。
(5)己知反应④:4HCl(g)+O2![]() 2Cl2+2H2O(g),该反应也能制得氯气,则 MnO2、O2、KMnO4。三种物质氧化性由强到弱的顺序为____________________________________________。
2Cl2+2H2O(g),该反应也能制得氯气,则 MnO2、O2、KMnO4。三种物质氧化性由强到弱的顺序为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示,下列各组物质中不能按图示关系转化的是
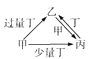
选项 | 甲 | 乙 | 丙 | 丁 |
A | Ca(OH)2 | Ca(HCO3)2 | CaCO3 | CO2 |
B | FeCl3 | Fe | FeCl2 | Zn |
C | Fe | Fe(NO3)2 | Fe(NO3)3 | HNO3 |
D | SO2 | Na2SO3 | NaHSO3 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是35%
C. 增加C,B的平衡转化率不变
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mgL﹣1 . 其工业提取法有:
(1)空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴.该方法涉及的反应有:
①(写出离子方程式);
②3Br2+3CO32﹣═BrO3﹣+5Br﹣+3CO2↑;
③(写出离子方程式);
(2)空气吹出SO2吸收法.该方法基本同(1),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.写出溴与二氧化硫反应的化学方程式 .
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢﹣水双温交换法”富集HDO.其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO.如图为“硫化氢﹣水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线.写出100℃时所发生的反应的化学方程式;工业上富集HDO的生产过程中,可以循环利用的一种物质是 . 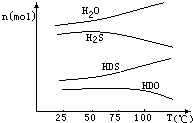
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验的解释或结论正确的是
选项 | 实验 | 解释或结论 |
A | 用无锈铁丝蘸取某溶液进行焰色 反应,火焰呈黄色 | 该溶液中一定含有Na+,一定不含K+ |
B | 将硫酸酸化的H2O2溶液滴入FeSO4溶液中,溶液变黄色 | H2O2的氧化性比Fe3+强 |
C | 将溴水滴入苯中,振荡后下层几乎无色 | 溴与苯发生加成反应 |
D | 向盛有冷水的烧杯中滴加FeCl3稀溶液并煮沸 | 制备Fe(OH)3胶体 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com