
| 化学方程式 | K (t1) | K (t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A、X2与H2反应的剧烈程度逐渐减弱 |
| B、HX的稳定性逐渐减弱 |
| C、HX的生成反应是放热反应 |
| D、在相同条件下,平衡时X2的转化率逐渐降低 |
| c2(HX) |
| c(X2)c(H2) |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
F2+H2 2HF 2HF |
1.8×1036 | 1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 | 4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 | 9.3×106 |
I2+H2 2HI 2HI |
43 | 34 |


查看答案和解析>>
科目:高中化学 来源: 题型:
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2 | 1.8×1036 | 1.9×1032 |
| Cl2+H2 | 9.7×1012 | 4.2×1011 |
| Br2+H2 | 5.6×107 | 9.3×106 |
| I2+H2 | 43 | 34 |
⑴已知t2>t1,HX的生成反应是 反应(填“吸热”或“放热”)。
⑵HX的电子式是 。
⑶共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 。
⑷X2都能与H2反应生成HX,用原子结构解释原因: 。
⑸K的变化体现出X2化学性质的递变性,用原子结构解释原因: ,原子半径逐渐增大,得电子能力逐渐减弱。
⑹仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加, (选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(北京) 题型:填空题
在温度t1和t2下,X2(g)和 H2反应生成HX的平衡常数如下表:
|
化学方程式 |
K (t1 ) |
K (t2) |
|
|
1.8 |
|
|
|
|
|
|
|
|
|
|
|
43 |
34 |
(1)已知t2 〉t1,HX的生成反应是 反应(填“吸热”或“放热”)。
(2)HX的电子式是 。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 。
(4)X2都能与H2反应生成HX,用原子结构解释原因: 。
(5)K的变化体现出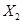 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,平衡于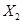 的转化率逐渐降低
的转化率逐渐降低
b. 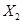 与
与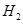 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱
c. HX的还原性逐渐
d. HX的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源:北京高考真题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com