
【题目】如图是元素周期表的一部分。

(1)②、⑥、⑧的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____ (用化学式表示)。
(3)As的原子结构示意图为_________其氢化物的化学式为__________;
(4)Y由②、⑥、⑧三种元索组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为__________,当消耗l mol还原剂时,电子转移了_____mol。
【答案】Cl->O2->Na+ HClO4>H3PO4>H2CO3 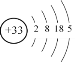 AsH3 5NaClO+2As+3H2O=2H3AsO4+5NaCl 5
AsH3 5NaClO+2As+3H2O=2H3AsO4+5NaCl 5
【解析】
(1)离子半径比较;
(2)非金属性的比较,元素非金属性越强,最高价含氧酸的酸性越强;
(1)②⑥⑧代表的元素分别为Na、O、Cl。它们的离子分别为Na+、O2-、Cl-。Cl-有3个电子层,而Na+和O2-电子层只要2个,则Cl-的半径最大。Na+和O2-的核外电子排布相同,核电荷数越大,半径越小,则Na+半径小于O2-,由大到小的顺序为Cl->O2->Na+;
(2)④⑦⑧代表的元素分别为C、P、Cl,它们最高价含氧酸分别为H2CO3、H3PO4、HClO4。非金属性越强,其最高价氧化物的水化物的酸性越强,则HClO4的酸性比H3PO4的酸性强,H2CO3的酸性比H3PO4的酸性弱,排序为HClO4>H3PO4>H2CO3;
(3)As为33号元素,其各层电子数分别为2、8、18、5,其原子结构示意图为 。其与N同主族,氢化物与NH3类似,氢化物为AsH3;
。其与N同主族,氢化物与NH3类似,氢化物为AsH3;
(4)②⑥⑧分别是Na、O、Cl,Y的水溶液为常见的消毒剂,为NaClO。As可与NaClO反应得到H3AsO4,As的化合价升高,从0升高到+5,,则Cl的化合价降低,从+1到-1。化合价升降守恒,则As和NaClO的比例为2:5,根据原子守恒可以配平,方程式为5NaClO+2As+3H2O=2H3AsO4+5NaCl。还原剂为As,其化合价从0升高到+5,则消耗1molAs,电子转移5mol。


科目:高中化学 来源: 题型:
【题目】碳酸氢钠广泛地应用于生产、实验和日常生活中。某课外小组同学通过查阅资料对碳酸氢钠的性质和制法进行了系列实验,请你参与探究。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为______。
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是______(填化学式),白色沉淀可能是:①MgCO3;②Mg(OH)2;③Mg2(OH)2CO3。欲证明白色沉淀为②,简单的实验方法为______(操作、现象和结论)。
(3)电解Na2CO3溶液制NaHCO3的原理如图—1所示.
①电解初期,电解池中总反应方程式为______。
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2_____L(标况)。
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为______。
(4) “侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如图—2所示.
① 正确的操作是______(填序号)。
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、SO42-、K+、Cl- D. K+、Cl-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元化合物X是锂硫电池的电极材料,为探究其组成进行了如下实验:
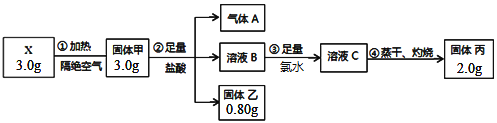
固体乙是一种单质,固体丙呈红棕色,将气体A通入溶液C中也能生成固体乙。
请回答:
(1)X的化学式是_________________,步骤①的化学方程式是_________________________。
(2)气体A通入溶液C发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表数据是对应物质的熔点:
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
熔点℃ | 920 | 801 | 1291 | 160 | -107 | 2072 | -57 | 1723 |
(1)上述涉及原子中最活泼非金属原子核外电子排布式是________________;某阴离子的轨道表示式为![]() ,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
(2)物质①的电子式:____________,⑦的结构式:_______________。
(3)④溶于水溶液呈酸性,用离子方程式表示其原因_______________________________;若把其溶液加热蒸干并灼烧,得到的固体是_______________。
(4)不能用于比较Na与Al金属性相对强弱的事实是_________________。
A.最高价氧化物对应水化物的碱性 B.Na最外层1个电子而Al 最外层3个电子
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(5)⑧比⑦熔点高出很多,其理由是:_____________________________;①和②都属于离子晶体,但①比②的熔点高,请解释原因____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学式为![]() 的配合物的说法中正确的是
的配合物的说法中正确的是![]()
![]()
A. 配体是![]() 和
和![]() ,配位数是9
,配位数是9
B. 中心离子是![]() ,配离子是
,配离子是![]()
C. 内界和外界中的![]() 的数目比是2:1
的数目比是2:1
D. 加入足量![]() 溶液,所有
溶液,所有![]() 均被完全沉淀
均被完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是
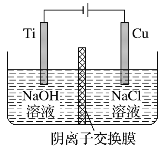
A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com