
【题目】下列图示与对应的叙述相符的是
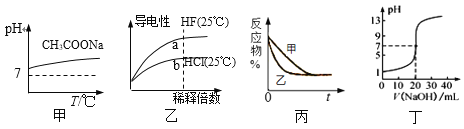
A. 图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B. 图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C. 图丙表示压强对可逆反应2A(g) +2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 图丁表示0.100 0 mol·L1 NaOH溶液滴定20.00 mL 0.100 0 mol·L1醋酸溶液的滴定曲线
【答案】A
【解析】
A.醋酸钠是强碱弱酸盐,水解使溶液显碱性,pH>7,盐的水解是吸热反应,升高温度,会促进盐的水解,因此,升高温度,醋酸钠的水解程度增大,溶液的pH增大,故A符合;
B.溶液的导电性与溶液中离子浓度大小有关,由于HF是弱酸,在溶液中存在电离平衡,加水稀释时,HF中离子浓度变化小,但比盐酸要大,溶液的导电能力比HCl强,由于温度相同,所以Kw的数值相同,故B不符合;
C.可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)是正反应方向为体积减小的方向,所以增大压强平衡正移,反应物的百分含量减小,与图象不符,故C不符合;
3C(g)+D(s)是正反应方向为体积减小的方向,所以增大压强平衡正移,反应物的百分含量减小,与图象不符,故C不符合;
D.醋酸为弱酸,0.10molL-1醋酸,其pH大于1,而图中开始pH=1,故D不符合。
故选A。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含![]() 和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:
和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:![]() ,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使![]() 转化
转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) >c(Cl-)
C.b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先用乙醇和浓硫酸为原料制取乙烯(CH3CH2OH![]() CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
CH2=CH2↑+H2O),将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。(已知:乙烯可以被浓硫酸氧化,有SO2生成)
乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请你回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是___________________。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是________,它与溴水反应的化学方程式是_________________。在验证过程中必须全部除去。为此,乙同学设计了如图所示的实验装置:

请回答:Ⅰ、Ⅱ、Ⅲ装置中可盛放的试剂是:Ⅰ________、Ⅱ________、Ⅲ________(填序号)。
A.品红 B.NaOH溶液
C.溴水 D.酸性高锰酸钾溶液
(3)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。丙池中盛有100 mL 3.00 mol.L-1的CuSO4溶液。试回答下列问题:
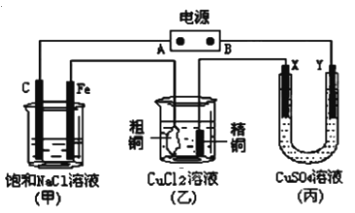
(1)在电源中,B电极为 极(填电极名称,下同);乙装置中粗铜为 极。
(2)在甲装置中,石墨(C)电极上发生 反应(填“氧化”或“还原”);甲装置中总的化学方程式是 。
(3)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为 L。
(4)在丙装置中, X电极上发生的电极反应式是 。
(5)在此过程中,若丙池中两电极产生的气体恰好相等时,理论上在乙池中精铜增加了 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O![]() NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
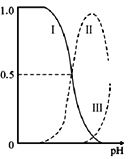
A. 曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+
B. 曲线Ⅰ与曲线II相交点对应pH=6.85
C. 乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-
[H3NCH2CH2NH3]2++OH-
D. 0.1 mol/LH2NCH2CH2NH3Cl溶液中各离子浓度大小关系为:c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明可逆反应P(g)+Q(g)![]() R(g)+S(g)在恒温条件下达到平衡状态的事实是
R(g)+S(g)在恒温条件下达到平衡状态的事实是
A.反应器内的压强不随时间的变化而变化
B.反应器内P、Q、R、S四种气体共存
C.生成P的速率与生成S的速率相等
D.生成1molP必有1molQ生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com