
(Ⅰ)(8分)在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示的平均反应速率为____________A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度____________(填“增大”、“减少”或“不变”)。
(3)若向原平衡体系再投入1 mol A和1 mol B,平衡____________(填“右移、左移或不移”)。
(4)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入____________ mol A物质,____________mol B物质。
(Ⅱ)(6分)现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(2)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______b(填“大于”、“小于”或“等于”)。
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Z>Y
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能存在Al3+、Cl-、Mg2+、Na+ 、 Br-、CO32-、SO32-等七种离子中的几种。现取该溶液进行实验,得到如下现象:
①向该溶液中滴加足量氯水后有无色无味气体产生,再加入CCl4振荡,下层液体呈红棕色;②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀产生;
③向所得溶液中继续滴加AgNO3溶液,有不溶于HNO3的白色沉淀产生。
据此可以推断,该溶液中肯定存在的离子是_____________,可能存在的离子是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.10mol·L-1的盐酸滴定0.10mol·L-1的氨水,滴定过程中不可能出现的结果是
A.c(NH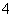 )>c(Cl-),c(OH-)>c(H+) B.c(NH
)>c(Cl-),c(OH-)>c(H+) B.c(NH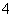 )=c(Cl-),c(OH-)=c(H
)=c(Cl-),c(OH-)=c(H
C.c(Cl-)>c(NH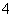 ),c(OH-)>c(H+) D.c(Cl-)>c(NH
),c(OH-)>c(H+) D.c(Cl-)>c(NH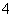 ),c(H+)>c(OH-)
),c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+,由此可判断有关离子的还原性从强到弱的顺序是( )
A.Br->Fe2+>I- B.I->Fe2+>Br- C.Br->I->Fe2+ D.Fe2+>I->Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成。工业上对其进行综合利用的流程如下:
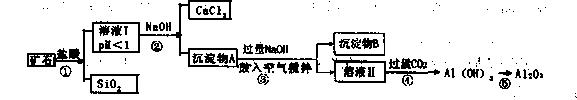
(1)SiO2的用途广泛,试写出其中的一种重要用途 ;
(2)溶液Ⅰ中除了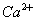 外,还含有的金属阳离子有 ;
外,还含有的金属阳离子有 ;
(3)步骤③中NaOH参加反应的离子方程式是 ,鼓入空气并充分搅拌的目的是 。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是
(5)试设计实验证明榴石矿中含有FeO(试 剂任选,说明实验操作与现象)
剂任选,说明实验操作与现象)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com