
【题目】已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知1mol单质碳完全燃烧放出热量为Y kJ,则1molC与O2反应生成CO的热量变化为
A.放出Y kJ B.放出(5X-5Y) kJ
C.放出(10X-Y) kJ D.吸收(10X-Y) kJ
【答案】B
【解析】
试题分析:碳在氧气中燃烧,氧气不足发生反应2C+O2![]() 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2![]() CO2。3.6g碳的物质的量为n(C)=3.6g÷12g/mol=0.3mol,6.4g的氧气的物质的量为n(O2)=6.4g÷32g/mol =0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生。假设生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2mol,y=0.1mol。单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol× YkJ/mol =0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ.由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-(XkJ0.1YkJ)÷0.2mol=-(5X-0.5Y)kJ/mol,选项B正确。
CO2。3.6g碳的物质的量为n(C)=3.6g÷12g/mol=0.3mol,6.4g的氧气的物质的量为n(O2)=6.4g÷32g/mol =0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生。假设生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2mol,y=0.1mol。单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol× YkJ/mol =0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ.由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-(XkJ0.1YkJ)÷0.2mol=-(5X-0.5Y)kJ/mol,选项B正确。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为CoO2+LiC6![]() LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A. 充电时,电池的负极反应为LiC6-e-Li++C6
B. 放电时,电池的正极反应为CoO2+Li++e-LiCoO2
C. 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D. 锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。
【I】日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献。请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是___________。
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
(2)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
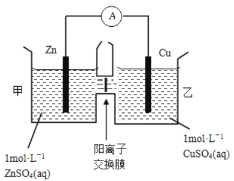
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
【II】自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(3)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应的可用离子方程式表示为___________。
(4)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,己知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
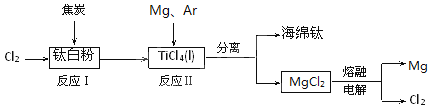
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)反应Ⅰ在800~900℃下进行,还生成一种可燃性无色气体,
该反应的化学方程式为 。
(2)反应Ⅱ的热化学方程式为 。
(3)反应Ⅱ中充入气体Ar的原因是 。
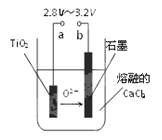
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右上图所示。
图中b是电源的 极,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
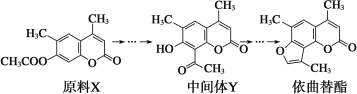
下列说法不正确的是( )
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去、氧化、还原反应
D.1 mol依曲替酯能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O![]() NaClO3+H2↑(未配平)
NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3![]() 3KClO4+KCl,将产物分离得到KClO4。
3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为 L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是 。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知: Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)= mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属单质在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置:____________,UW2的电子式为____________;
(2)写出下列反应的化学方程式,Z在高温下与水反应_______________________________________;
(3)U、V、W形成的10电子氢化物中,氢化物的稳定性从强到弱的顺序是____________(写化学式),V元素的氢化物极易溶于水的主要原因是__________________________,该氢化物与空气可以构成一种环保燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_________________(填仪器名称)。
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
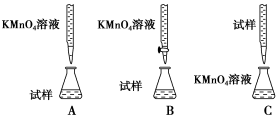
方案二 重量法 操作流程如下:

(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:______________________________________________。
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量。
II:六水合硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1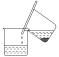 图2
图2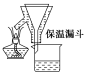
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。向锥形瓶中加入30mL的3 mol·L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
步骤3:六水合硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体。
请回答下列问题:
(1)趁热过滤的目的和理由是________________________________________________。
(2) ①步骤3中的一系列操作包括:_________________________________。
②洗涤硫酸亚铁铵晶体最好用什么试剂:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
(1)当n=2时,AB2属于__________分子(填“极性”或“非极性”),分子中有__________个δ键、__________个π键。A6H6分子中A原子的杂化轨道类型是__________杂化。
(2)当n=3时,A与B形成的晶体属于__________晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是__________(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为____________________。
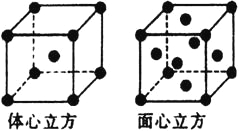
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com