
����Ŀ��U��V��W��X��Y��Z��ԭ������������������ֳ���Ԫ�ء�Y�ĵ�����W2��ȼ�յIJ����ʹƷ����Һ��ɫ��Z��WԪ���γɵĻ�����Z3W4���д��ԡ�U�ĵ�����W2��ȼ�տ�����UW��UW2�������塣X�ĵ�����һ�ֽ������ý���������UW2�о���ȼ�����ɺڡ������ֹ��塣
��ش��������⣺
��1��X�����ڱ��е�λ�ã�____________��UW2�ĵ���ʽΪ____________��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��Z�ڸ�������ˮ��Ӧ_______________________________________��
��3��U��V��W�γɵ�10�����⻯���У��⻯����ȶ��Դ�ǿ������˳����____________(д��ѧʽ)��VԪ�ص��⻯�K������ˮ����Ҫԭ����__________________________�����⻯����������Թ���һ�ֻ���ȼ�ϵ�أ��������Һ��KOH���为���ĵ缫��ӦʽΪ____________��
���𰸡���1���������ڵ� ��A �壻![]()
��2��3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
��3�� H2O��NH3��CH4��NH3��H2O����������2NH3�D6e��+6OH����N2+6H2O
�����������������Y�ĵ�����W2��ȼ�յIJ����ʹƷ����Һ��ɫ��������ΪSO2����YΪSԪ�أ�WΪOԪ�أ�Z�ĵ�����W��ȼ�����ɵĻ�����Z3W4���д��ԣ���Z3W4ΪFe3O4��ZΪFeԪ�أ�U�ĵ�����W2��ȼ�տ�����UW��UW2�������壬Uԭ������С��OԪ�أ�ӦΪCO��CO2���壬UΪCԪ�أ�X�ĵ�����һ�ֽ������ý�����UW2�о���ȼ�����ɺڡ������ֹ��壬ӦΪMg��CO2�ķ�Ӧ����XΪMgԪ�أ�V��ԭ����������̼����֮�䣬��VΪNԪ�ء�
��1��XΪMgԪ�أ������ڱ���λ�ڵ������ڵ� ��A �壻CO2�ĵ���ʽΪ![]() ���ʴ�Ϊ���������ڵ� ��A �壻
���ʴ�Ϊ���������ڵ� ��A �壻![]() ��
��
��2�� ���ڸ�������ˮ��Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O(g)![]() Fe3O4+4H2�����ʴ�Ϊ��3Fe+4H2O(g)
Fe3O4+4H2�����ʴ�Ϊ��3Fe+4H2O(g)![]() Fe3O4+4H2����
Fe3O4+4H2����
��3��Ԫ�صķǽ�����Խǿ���⻯��Խ�ȶ���U��V��W�γɵ�10�����⻯���У��⻯����ȶ��Դ�ǿ������˳����H2O��NH3��CH4��NH3��H2O�����γ������ʹ�ð���������ˮ������������Թ���һ�ֻ���ȼ�ϵ�أ������ϰ�ʧȥ���ӷ���������Ӧ���缫��ӦʽΪ2NH3�D6e��+6OH����N2+6H2O���ʴ�Ϊ��H2O��NH3��CH4��NH3��H2O�����γ������2NH3�D6e��+6OH����N2+6H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��5���л���ѧ����]����һ��߷���ҩ��P�ĺϳ�·�����£�

��֪��
��1��AΪһԪ���ᣬ8.8g A������NaHCO3��Һ��Ӧ����2.24L CO2����״������A�ķ���ʽ��
��
��2��B��E�ĺ˴Ź�������ֻ��2�ַ壬D��ϵͳ������ ��E���еĹ������� ��
��3��D�������E��Ӧ����F����D���������õ�F�䡣F��Ľṹ��ʽ�� ��
��4����Ӧ�������� ��G����P�ķ�Ӧ���� ��
��5��P��NaOHˮ��Һ�����Ļ�ѧ����ʽ�� ��
��6��д��2�ַ�������Ҫ��IJ���ҵ�ͬ�ֵ����壺�ٺ��б���������������˴Ź�������Ϊ4��壬�ҷ������Ϊ9��6��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
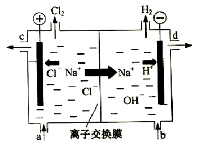
���������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ��
��2�����ӽ���Ĥ������Ϊ�� ��
��
��3�����Ʊ���ʳ��ˮ��ͼ�� λ�ò��䣬����������Һ��ͼ�� λ����������ѡ�a������b������c����d����
��4��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪3.6g̼��6.4g������ȼ�գ�����Ӧ��ľ������ų�X kJ��������֪1mol����̼��ȫȼ�շų�����ΪY kJ����1molC��O2��Ӧ����CO�������仯Ϊ
A���ų�Y kJ B���ų�(5X-5Y) kJ
C���ų�(10X-Y) kJ D������(10X-Y) kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ�Һϳ���һϵ�о��ж��ػ�ѧ���Ե�����������(AlH3)n����������ԭ������֪�������������Ļ�ѧʽΪAl2H6�������۵�Ϊ150��������״̬���ܵ��磬ȼ��ʱ�ų�������������Al2H6�����ģ����ͼ��ʾ������˵���������
A. Al2H6��AlΪ��3�ۣ�HΪ��1��
B. Al2H6�к������Ӽ��ͼ��Թ��ۼ�
C. Al2H6�ڹ�̬ʱ���γɵľ����Ƿ��Ӿ���
D. Al2H6�ڿ�������ȫȼ�գ�����Ϊ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��������ۺ���������Ӧ���������졣����˵����ȷ����
A����������������������������
B���������е����뾶��r(Al3+)��r(O2-)
C���ڸ÷�Ӧ�У����Ļ�ԭ��ǿ�����Ļ�ԭ��
D��1mol�������μӷ�Ӧת�Ƶ�����ԼΪ4��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L������X.��Y��Z�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ�����
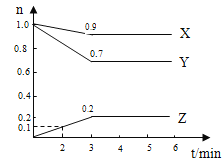
��1���÷�Ӧ�Ļ�ѧ����ʽΪ
��2����Ӧ��ʼ��2min��Z��ƽ����Ӧ����Ϊ ��
��3��ƽ��ʱX���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
���̿���Ҫ�ɷ�ΪMnO2���������Ʊ��̼��仯���
��1������ұ�������̵�һ�ַ��������������̿�����Mn3O4�����������ȷ�Ӧԭ���Ƶ��̣������ȷ�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2���ִ�ұ�������̵�һ�ֹ�����������ͼ��ʾ��
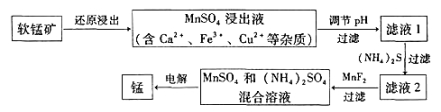
�±�Ϊt��ʱ���й����ʵ�pKsp��ע��pKsp =��lgKsp����
���� | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
���̿�ԭ�����ķ�ӦΪ��12MnO2��C6H12O6��12H2SO4 ![]() 12MnSO4��6CO2����18H2O
12MnSO4��6CO2����18H2O
���÷�Ӧ�У���ԭ��Ϊ_______��д��һ�������ԭ�������ʵĴ�ʩ��_______��
����Һ1��pH_______����������������С����������������MnSO4����Һ��pH��
�ۼ���MnF2����ҪĿ���dz�ȥ ����Ca2+��Fe3+��Cu2+����
��3����MnSO4��ȡMnCO3����MnSO4��Һ�м������NH4HCO3��Һ���÷�Ӧ�����ӷ���ʽΪ____________������MnSO4��Һ�м���(NH4)2CO3��Һ���������Mn(OH)2�����ܵ�ԭ������MnCO3(s)��2OH��(aq)![]() Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
Mn(OH)2(s)��CO32-(aq)��t ��ʱ������÷�Ӧ��ƽ�ⳣ��K�� ������ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ����������ȡ�봢��������Դ����������о��ȵ㡣
I����֪�� �� 4HCl(g)+O2(g) ![]() 2Cl2��g��+2H2O��g����H=-115.6kJ/mol
2Cl2��g��+2H2O��g����H=-115.6kJ/mol
��H2��g��+Cl2��g��=2HCl��g����H=-184kJ/mol
��֪�Ͽ�1mol H-H����������Ϊ436kJ���Ͽ�1molO=O����������Ϊ496kJ���Ͽ�1molCl-Cl����������Ϊ243KJ����
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ��
��2���Ͽ�1molH-O����������Ϊ kJ��
��.��֪�� CH4��g��+H2O��g���TCO��g��+3H2��g�� ��H=+206.2kJmol-1 ��
CH4��g��+CO2��g���T2CO��g��+2H2��g�� ��H=+247.4kJmol-1 ��
��֪CH4��ȼ����Ϊ890.3kJ/mol��
��1������������֪����д��������ȫȼ�յ��Ȼ�ѧ����ʽ�� ��
��2���Լ���Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����CH4(g)��H2O(g)��Ӧ����CO2(g)��H2(g)���Ȼ�ѧ����ʽΪ________________________________��
��3��������H2O�ɷֽ����ɷ��ӻ�ԭ�ӡ�������ˮ�ֽ���ϵ����Ҫ���������������¶ȵĹ�ϵ��ͼ��ʾ��ͼ��B��ʾ������_______�������ƣ�����������A��H2��ѧ�ܽϵ͵�������_______���ѧʽ����
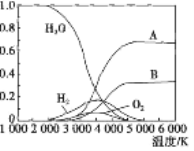
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com