
【题目】[化学——选修2:化学与技术]
软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为_______________。
(2)现代冶炼金属锰的一种工艺流程如下图所示:
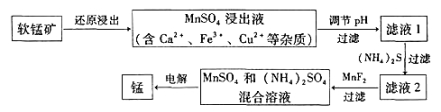
下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4 ![]() 12MnSO4+6CO2↑+18H2O
12MnSO4+6CO2↑+18H2O
①该反应中,还原剂为_______。写出一种能提高还原浸出速率的措施:_______。
②滤液1的pH_______(填“大于”、“小于”或“等于”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)。
(3)由MnSO4制取MnCO3:往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为____________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)![]() Mn(OH)2(s)+CO32-(aq),t ℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s)+CO32-(aq),t ℃时,计算该反应的平衡常数K= (填数值)。
【答案】(1)8Al + 3Mn3O4![]() 4Al2O3+ 9Mn;
4Al2O3+ 9Mn;
(2)①C6H12O6,升高反应温度(或将软锰矿研细等其他合理答案);②大于;③Ca2+ ;
(3)Mn2++2HCO3-=MnCO3↓+ H2O + CO2↑,100。
【解析】
试题分析:(1)铝热反应的实质利用铝的强金属性,把弱金属性金属置换出来,8Al + 3Mn3O4![]() 4Al2O3+ 9Mn;
4Al2O3+ 9Mn;
(2)①还原剂是失电子,化合价升高被氧化,根据上述化合价的分析,C6H12O6中H为+1、O为-2,整个化合价的代数和为0,则C的化合价为0,CO2中C的化合价为+4价,即还原剂为C6H12O6,MnO2中Mn的化合价为+4价→+2价,提高还原浸出速率的措施为:升高温度、研细软锰矿等;②软锰矿还原浸出得到MnSO4溶液,说明浸出液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的pKsp为37.4与其他离子相比最大,pKsp=-lgKsp,pKsp越大,沉淀溶解平衡常数越小,滤液1为形成Fe(OH)3沉淀,pKsp=-lgKsp=37.4,Ksp=10-37.4,Ksp=c(Fe3+)×c2(OH-),c(OH-)≈10-10,c(H+)=1×10-4mol·L-1,pH=4,滤液1的pH大于MnSO4浸出液的pH;③向溶液中加热硫化铵,CuS的pKsp为35.2,可以将Cu2+形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后得到的含有锰离子的盐电解,可以达到金属锰;
(3)Mn2+和HCO3-发生成MnCO3、水和CO2,离子反应方程式为:Mn2++2HCO3-=MnCO3↓+ H2O + CO2↑,由MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO32-(aq)可知,Ksp=c(CO32-)/c2(OH-)= [Ksp(MnCO3)/c(Mn2+)] /[Ksp(Mn(OH)2)/c(Mn2+)]=10-10.7/10-12.7=100。
Mn(OH)2(s)+CO32-(aq)可知,Ksp=c(CO32-)/c2(OH-)= [Ksp(MnCO3)/c(Mn2+)] /[Ksp(Mn(OH)2)/c(Mn2+)]=10-10.7/10-12.7=100。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活。
【I】日常生活中使用的各种电池就是利用化学反应将化学能转化为电能,各种各样的电池的发展是化学对人类的一项重大贡献。请回答下列有关化学电源的问题:
(1)下列有关电池的叙述中正确的是___________。
A.锌锰干电池工作一段时间后碳棒变细 B.氢氧燃料电池可将热能直接转变为电能
C.甲烷燃料电池工作时甲烷在负极被氧化 D.太阳能电池的主要材料是高纯度的二氧化硅
(2)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
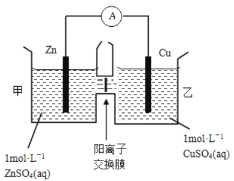
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.甲池中的阳离子向乙池移动,保持溶液中电荷平衡
【II】自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(3)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应的可用离子方程式表示为___________。
(4)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,己知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属单质在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置:____________,UW2的电子式为____________;
(2)写出下列反应的化学方程式,Z在高温下与水反应_______________________________________;
(3)U、V、W形成的10电子氢化物中,氢化物的稳定性从强到弱的顺序是____________(写化学式),V元素的氢化物极易溶于水的主要原因是__________________________,该氢化物与空气可以构成一种环保燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_________________(填仪器名称)。
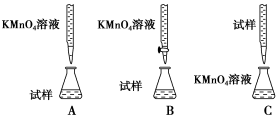
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
方案二 重量法 操作流程如下:

(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:______________________________________________。
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量。
II:六水合硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1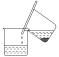 图2
图2
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。向锥形瓶中加入30mL的3 mol·L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
步骤3:六水合硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体。
请回答下列问题:
(1)趁热过滤的目的和理由是________________________________________________。
(2) ①步骤3中的一系列操作包括:_________________________________。
②洗涤硫酸亚铁铵晶体最好用什么试剂:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
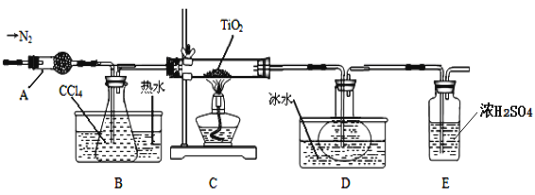
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学 选修2:化学与技术]
铵盐是重要的化工原料,以N2和H2为原料制取硝酸铵的流程图如下,请回答下列问题:

(1)在上述流程图中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)在上述工业生产中,N2与H2合成NH3的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

![]() 分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3 。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。

(3)NH3和CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g) ![]() CO( NH2)2(s)+H2O(g)
CO( NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。则:
①b应控制在 ; A.1.5.1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 。
(4)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(5)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(6)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O22+中含有的π键数目为____________________。
(2)Fe2(SO4)3晶体中铁离子的核外电子排布式为 。
(3)乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
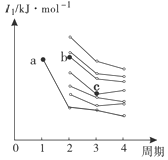
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(5)亚硝酸的酸性强于次氯酸的原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
(1)当n=2时,AB2属于__________分子(填“极性”或“非极性”),分子中有__________个δ键、__________个π键。A6H6分子中A原子的杂化轨道类型是__________杂化。
(2)当n=3时,A与B形成的晶体属于__________晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是__________(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为____________________。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为__________。
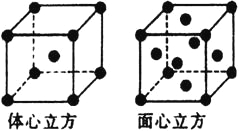
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用
能,还能为农业生产提供优良的肥料。已知: 标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为 。
②如果上述反应生成的是水蒸气,则反应放出的热量 4448kJ。(填“>”或“<”或“=”)
(2)已知拆开1 mol H-H键、1 molN≡N、1 mol N-H键分别需要吸收的能量为436 .4kJ、941.3 kJ、390.5 kJ。则由1 mol NH3 分解生成氢气和氮气需要 (填“放出”或“吸收”) kJ的热量。
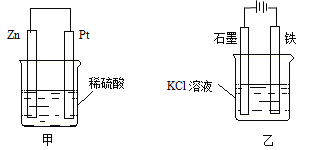
(3)在生产和生活中经常遇到化学能与电能的相互转化。在下列甲、乙两装置中,甲中负极电极反应式为 ;乙中铁电极的电极反应式为 ,铁电极发生 反应(填“氧化”或“还原”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com