
【题目】某温度时,在2L容器中X.、Y、Z三种物质的物质的量随时间变化曲线如右图所示,由图中数据分析,
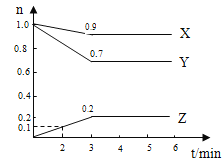
(1)该反应的化学方程式为
(2)反应开始至2min、Z的平均反应速率为 。
(3)平衡时X的体积分数为 。
【答案】(1)X +3Y![]() 2Z(2)0.025mol· L-1·min-1(3)50%
2Z(2)0.025mol· L-1·min-1(3)50%
【解析】
试题分析:(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,则有Y:X:Z=(1.0mol-0.9mol):(1)0mol-0.7mol):0.2mol=1:3:2,则反应的化学方程式为X +3Y![]() 2Z。
2Z。
(2)反应开始至2min,用Z表示的平均反应速率为v=△c/△t=0.1/2×2=0.025mol.L-1.min-1。
(3)平衡时X的体积分数=0.9/(0.9+0.7+0.2)=0.5=50%.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
已知碳元素能形成多种金属碳化物,如碳化钙,俗称为电石。
(1)电石(CaC2)是用CaO与焦炭在电炉中加强热反应生成的,写出此反应的化学方程式 ,CaC2中含有化学键的类型为 ,C22-与N2互为等电子体,C22-的电子式可表示为 ,其中σ键和π键数目之比为 。
(2)已知MgO、CaO的熔点分别为2852℃、2614℃,分析熔点差异的原因是 。
(3)苯丙氨酸是一种重要的氨基酸,其结构如图所示,分子中第一电离能最大的原子价电子排布式是 ,其中碳原子的杂化方式有 。
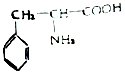
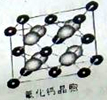
(4)已知CaF2晶体(如图,Ca2+处于面心)的密度为ρg/cm3,NA为阿伏加德常数,相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量(M)可以表示为 g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
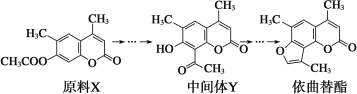
下列说法不正确的是( )
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去、氧化、还原反应
D.1 mol依曲替酯能与2 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属单质在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)X在周期表中的位置:____________,UW2的电子式为____________;
(2)写出下列反应的化学方程式,Z在高温下与水反应_______________________________________;
(3)U、V、W形成的10电子氢化物中,氢化物的稳定性从强到弱的顺序是____________(写化学式),V元素的氢化物极易溶于水的主要原因是__________________________,该氢化物与空气可以构成一种环保燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,硫碘循环制氢主要的热化学方程式为:
Ⅰ.SO2(g)+2H2O(l)+I2(g)=H2SO4 (l)+2HI(g) △H=35.9 kJ/mol
Ⅱ.2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=470kJ/mol
Ⅲ.2HI(g)=H2(g)+I2(g) △H=14.9kJ/mol
(1)反应2H2(g)+ O2(g)=2H2O(l)的△H= mol·L-1。
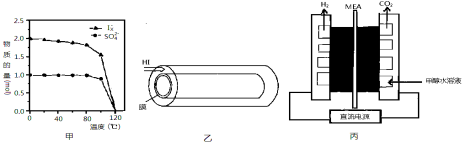
(2)反应Ⅰ在液相中发生称为bensun反应,向水中加入1mol SO2和3mol I2,在不同温度下恰好完全反应生成的n(SO42-)和n(Ix-)的变化见图甲。
①Ix-中x= 。②温度达到120℃时,该反应不发生的原因是 。
(3)反应Ⅲ是在图乙中进行,其中的高分子膜只允许产物通过,高分子膜能使反应程度 ___ (填“增大”、“减小”或“不变”),在该装置中为了进一步增大达平衡时HI的分解率;不考虑温度的影响,还可以采取的措施为 。
(4)图丙是一种制备H2的方法,装置中的MEA为允许质子通过的电解质膜。
①写出阳极电极的反应式: 。
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_________________(填仪器名称)。
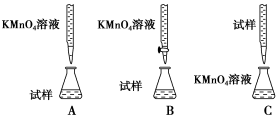
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
方案二 重量法 操作流程如下:

(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:______________________________________________。
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量。
II:六水合硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1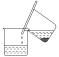 图2
图2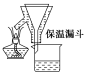
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。向锥形瓶中加入30mL的3 mol·L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
步骤3:六水合硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体。
请回答下列问题:
(1)趁热过滤的目的和理由是________________________________________________。
(2) ①步骤3中的一系列操作包括:_________________________________。
②洗涤硫酸亚铁铵晶体最好用什么试剂:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
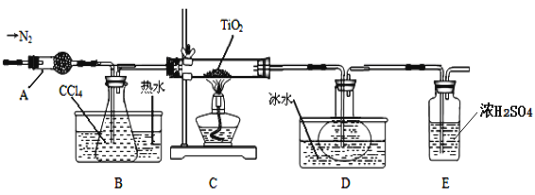
【题目】TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究。
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | —23 | 76 | 与TiCl4互溶 |
TiCl4 | —25 | 136 | 遇潮湿空气产生白雾 |
请回答下列问题:
(1)仪器A的名称是 。
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃
酒精灯⑥停止通N2⑦停止加热。正确的操作顺序是__________________________。实验结束后欲分离D中的液态混合物,所采用操作的名称是 。
(3)装置E能否 (填“能”或“不能”)换成装置A,理由是 。
(4)TiCl4是制取航天航空工业材料——钛合金的重要原料。某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素。 。
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2。
(5)写出生成TiO2·xH2O的化学方程式 。
(6)检验沉淀是否洗涤干净的方法是___________________________________________。
(7) 一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取上述TiO2试样0.2g,消耗0.1 mol·L-1 NH4Fe(SO4)2标准溶液20mL 。
。
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是: 。
②该滴定操作所用到的指示剂是 。
③则TiO2质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O22+中含有的π键数目为____________________。
(2)Fe2(SO4)3晶体中铁离子的核外电子排布式为 。
(3)乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
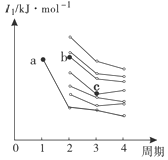
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(5)亚硝酸的酸性强于次氯酸的原因为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过比较两种最高价氧化物的水化物的酸性强弱来验证硫与碳的非金属性强弱,它采用了如图所示的装置进行试验。请回答:
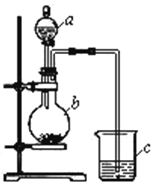
(1)仪器a的名称是____________,应盛放下列药品中的_______。
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2)仪器b的名称是____________,应盛放下列药品中的______。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的药品是____________,如果看到的现象是____________________,证明b中反应产生了_____________________,即可证明__________比_________酸性强,非金属性__________比__________强,b中发生反应的离子方程式为__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com