
【题目】气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是 ( )
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |

A. 上述气体检测时,敏感电极均作电池正极
B. 检测H2S气体时,对电极充入空气,该电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
C. 检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
D. 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
【答案】C
【解析】A.失电子发生氧化反应的电极是负极、得电子发生还原反应的电极是正极,根据待测气体和反应产物可知,部分气体中元素化合价上升,部分气体中元素的化合价下降,所以敏感电极不一定都做电池正极,故A错误;B.检测硫化氢时,硫化氢生成硫酸,硫元素化合价由-2价变为+6价而发生氧化反应,则其所在电极为负极,正极上氧气得电子和氢离子反应生成水,电极电极反应式为O2+4H++4e-═2H2O,故B错误;C.检测Cl2气体时,Cl2生成HCl,氯元素化合价由0价变为-1价发生还原反应,则敏感电极的电极反应为:Cl2 + 2e-= 2Cl-,故C正确;D.产生的电流大小与得失电子多少有关,检测H2S和CO体积分数相同的两份空气样本时,硫化氢失去电子数大于CO,所以产生电流大小不同,故D错误;故选C。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】已知298K时反应2SO2(g)+O2(g)═2SO3(g)△H=-197kJmol-1,在相同温度下向一密闭容器中加入2molSO2和1molO2,达化学平衡时放出热量为a1kJ;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达化学平衡时放出热量为a2kJ,则下列关系式中正确的是( )
A. 2a2>a1>197 B. 2a2<a1<197 C. 2a2=a1>197 D. 2a2=a1=197
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构为:有关原花青素的下列说法不正确的( )
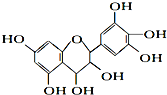
A.该物质既可看作醇类,也可看作酚类
B.1mol该物质可与4mol Br2反应
C.1mol该物质可与7mol Na反应
D.1mol该物质可与7mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
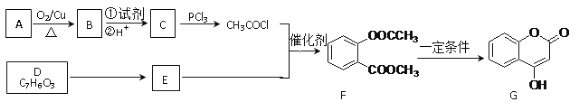
已知:RCOOH![]() RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
请回答下列问题:
⑴B→C的转化所加的试剂可能是__________,C+E→F的反应类型是_______。
⑵有关G的下列说法正确的是_________。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1mol G最多可以跟4mol H2反应
⑶E的结构简式为_________。
⑷F与足量NaOH溶液充分反应的化学方程式为__________________________________。
⑸写出同时满足下列条件的E的同分异构体的结构简式_______________。
①发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
⑹已知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是 ;
31Ga的第一电离能却明显低于30Zn,原因是 ;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3 分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是: (用相关的离子方程式和简单的文字说明加以解释)
(3)图甲所示的二维平面晶体示意图中表示化学式为AX3的是________。
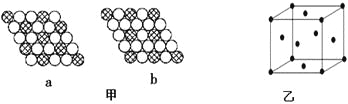
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒:
A.12C和14C B.O2和O3
C.H、D、T D.金刚石和石墨
E.CH3OH和![]()
F. 和
和![]()
用序号填空:
(1)互为同位素的是______;
(2)互为同素异形体的是______;
(3)互为同分异构体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在与Al反应能放出H2的无色溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42-③Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A.①③B.③⑤C.③④D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com